 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2418 | Gradito: |
Leggi anche appunti:Verso il disastro: le bombe su hiroshima e nagasakiVERSO IL DISASTRO: LE BOMBE SU HIROSHIMA E NAGASAKI 1 LA DECISIONE FINALE Composti carbossiliciComposti carbossilici Sono i composti caratterizzati dalla presenza Il profilo di energia di una reazioneIl profilo di energia di una reazione Reazione a un unico stadio. Consideriamo |
 |
 |
La titolazione è una tipica operazione dell'analisi chimica che consiste nel determinare la concentrazione o titolo di una specie chimica in soluzione (analita), facendola reagire con una quantità nota di un dato reagente, detto titolante.
Le titolazioni possono essere basate su qualsiasi tipo di reazione chimica. I requisiti principali per la
reazione sono la completezza (deve avere una elevata costante di equilibrio), e la rapidità. Le titolazioni più comuni si basano su reazioni di precipitazione, di formazione di complessi, di ossidoriduzione e acido-base.
Le titolazioni acido-base, ad esempio, permettono di determinare quanto acido (o base) è presente in una soluzione (di concentrazione incognita), misurando la quantità di soluzione basica (o acida) di concentrazione nota, necessaria per reagire in modo completo con la soluzione da titolare, producendo un processo di completa salificazione.
In realtà, come sappiamo, le reazioni chimiche sono soggette ad equilibri e non si completano quasi mai. Quando si parla di una reazione che avviene completamente, nella maggior parte dei casi si sottintende il fatto che l'equilibrio è talmente spostato verso i prodotti da poter considerare la reazione completa. Spesso si descrivono queste reazioni dicendo che avvengono "in modo quantitativo".
Si assume che la titolazione possa definirsi quantitativa quando, al termine della reazione, la concentrazione residua dell'analita sia uguale allo 0.1% della sua concentrazioni iniziale
[Analita]fin = 10-3 [Analita]iniz
Come vedremo ciò pone delle condizioni alla titolabilità delle soluzioni, le quali non possono contenere un analita troppo diluito e/o troppo debole, che impedirebbe il verificarsi di una reazione quantitativa.
Naturalmente il problema delle titolazioni è quello di riuscire a sapere a che punto del processo l'aggiunta dell'agente titolante ha provocato la completa salificazione della soluzione. Tale punto è detto punto di equivalenza (o punto stechiometrico), poiché un acido reagisce completamente con una base quando le due specie chimiche sono presenti in soluzione con un ugual numero di equivalenti.
Naturalmente quando viene raggiunto il punto di equivalenza, e l'acido e la base si sono completamente trasformati nel sale, il pH non è necessariamente neutro, in quanto alcuni sali presentano idrolisi acida o basica.
Per individuare il momento in cui viene raggiunto il punto di equivalenza è necessario operare immergendo nella soluzione un indicatore che presenti un pH di viraggio uguale al pH della soluzione salina.
Il punto di equivalenza è solo teorico. Sperimentalmente si determina il punto finale a cui è associato il cambiamento di colore dell'indicatore.
L'occhio umano riesce infatti ad apprezzare il colore quando le due concentrazioni variano almeno di 10 volte. Ad esempio per un generico indicatore acido HIn, il colore A predomina quando il rapporto [In-]/[HIn] < 0.1 ed il colore B quando [In-]/[HIn] > 10
L'intervallo di viraggio di un indicatore sarà dunque pari a pH = pkind ± 1. Supponendo ad esempio di impiegare un indicatore acido con ka= 10-5, il viraggio del colore verrà apprezzato quando il pH varia tra 6 e 4 (intervallo di viraggio dell'indicatore).
In generale si sceglie un indicatore il cui intervallo di viraggio coincida il più possibile con la parte più ripida della curva. La scelta dell'indicatore è quindi basata sulla k dell'acido(o base) da titolare e sulla sua concentrazione.
Dato che gli indicatori sono acidi/basi, essi reagiscono con l'analita o il titolante. Per questo motivo l'indicatore viene quindi usato in piccole quantità (gocce) in modo che la sua concentrazione risulti trascurabile rispetto a quelle dell'analita e del titolante..
Se la titolazione viene effettuata con un acido forte ed una base forte il sale che si produce darà un'idrolisi neutra ed è quindi necessario utilizzare un indicatore che viri intorno a pH 7. Nel caso il sale che si forma al punto di equivalenza produca un'idrolisi basica od acida è necessario utilizzare un indicatore opportuno che viri a pH superiori od inferiori a 7.
Dato che il grado di idrolisi sarà diverso a seconda della forza dell'acido, l'indicatore deve essere scelto in funzione della ka dell'acido debole da titolare (o della kb della base debole), ma anche della sua concentrazione.
Purtroppo la concentrazione dell'acido debole (o della base debole) è proprio quella che dobbiamo trovare e quindi il pH del punto di equivalenza potrà essere stimato solo approssimativamente. Nel caso ad esempio dell'acido acetico (ka ≈ 10-5), il pH al punto di equivalenza potrà aggirarsi tra 8 e 9, a seconda della concentrazione dell'acido.
Se ad esempio assumiamo che l'acido abbia una concentrazione compresa tra 10-1 e 10-3, al punto di equivalenza la concentrazione degli ioni OH-, come conseguenza dell'idrolisi basica avrà valori compresi tra
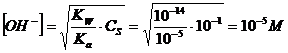 e
e 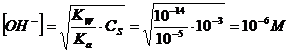
Quindi il pH di viraggio sarà compreso tra 8 e 9. Possiamo allora usare come indicatore la fenolftaleina che ha un intervallo di viraggio tra 8.3 e 10 (pkIn = ca. 9.3).
Nel caso delle titolazioni è opportuno esprimere le concentrazioni mediante la Normalità e quindi in eq/L. Tenendo infatti presente che la normalità di una soluzione è il rapporto tra il numero di equivalenti ed il volume della soluzione
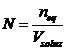
e che il punto di equivalenza si raggiunge quando il numero di equivalenti di acido è pari al numero di equivalenti di base
![]()
sostituendo opportunamente si ottiene la condizione di equivalenza per le titolazioni acido-base
![]()
Al punto di equivalenza il prodotto della normalità della soluzione acida per il suo volume è uguale al prodotto della normalità della soluzione basica per il suo volume.
Esempio 1
Calcoliamo la molarità di una soluzione di Ba(OH)2 sapendo che 35,5 mL di tale soluzione vengono completamente salificati da 40, 3 mL di HCl 0,2N.
Sostituendo i dati nella relazione di equivalenza otteniamo
![]()
L'unica incognita rimane la normalità della soluzione basica che risulta quindi pari a NB = 0,227 eq/L. Calcoliamo ora la molarità
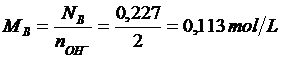
Esempio 2
250 mL di una soluzione 0,2 M di ione cromato ossidano completamente 2,8 g di una miscela di Zinco ed Alluminio in ambiente basico secondo le seguenti due reazioni
Al + CrO42- + H2O → Al3+ + Cr3+ + 8OH-
3Zn + 2CrO42- + 8H2O → 3Zn2+ + 2Cr3+ + 16OH-
Calcoliamo la composizione percentuale in peso della miscela.
In 250 mL di una soluzione 0,2 M di cromato vi sono
n = M x V = 0,2 x 0,25 L = 0,05 mol di CrO42-
Indichiamo con x il numero di moli di Alluminio che reagiscono con altrettante moli di cromato.
Indichiamo con 3y le moli di Zinco che reagiscono con 2y moli di cromato.
Allora per l'anione cromato dovrà essere
x + 2y = 0,05 (bilancio di massa)
e per la miscela Zinco (PM = 65,4 g/mol) Alluminio (PM = 27 g/mol)
x∙27 + 3y∙65,4 = 2,8 (bilancio di massa)
Ricaviamo la x dalla 1) e sostituiamola nella 2)
(0,05 - 2y)∙27 + 3y∙65,4 = 2,8
y = 0,0102
e quindi
x = (0,05 - 2y) = (0,05 - 0,0204) = 0,0296
Dunque la miscela Zinco/Alluminio è composta da
x = 0,0296 mol di Alluminio, pari a 0,0296∙27 = 0,8 g composizione percentuale Al = (0,8 / 2,8) x 100 = 28,6%
3y = 0,0306 mol di Zinco, pari a 0,0306∙65,4 = 2,0 g composizione percentuale Zn = (2,0 / 2,8) x 100 = 71,4%
* * * * * *
|
|
|
Per eseguire una titolazione occorre una buretta, ossia un tubo di vetro accuratamente graduato (in decimi o ventesimi di mL), terminante con un rubinetto, che permetta di versare la soluzione titolante goccia a goccia. La soluzione da titolare (analita), nella quale si pone una goccia di un opportuno indicatore di pH, viene mantenuta in costante agitazione in modo da renderla omogenea dopo ogni aggiunta. Non appena l'indicatore vira di colore si interrompe immediatamente l'aggiunta della soluzione titolante e si misura, tramite la scala graduata, il volume della soluzione uscita dalla buretta. |
Condizione indispensabile affinché il risultato della titolazione sia attendibile è ovviamente che la concentrazione della soluzione titolante sia nota con buona precisione. In altre parole, l'accuratezza del risultato analitico di una titolazione dipende dall'accuratezza della misura della concentrazione del titolante.
E' possibile conoscere la concentrazione del titolante solo se esso è stato preparato sciogliendo una quantità pesata di reagente puro in un volume noto di soluzione. In tal caso il reagente viene chiamato standard primario, poiché è sufficientemente puro per poter essere pesato ed usato direttamente.
Per essere affidabile uno standard primario dovrebbe
avere una purezza maggiore del 99,98 %,
essere stabile e reagire rapidamente completamente e selettivamente con l'analita
poter essere reperito facilmente, essere essiccabile (preferibilmente a 110-120°C) e conservabile allo stato puro;
rimanere inalterato durante le operazioni di pesata (non deve essere igroscopico, ossidabile all'aria o assorbire anidride carbonica);
poter essere analizzato con metodi idonei al fine della determinazione della purezza;
avere preferibilmente un alto peso equivalente in modo da minimizzare l'errore di pesata;
essere facilmente solubile in acqua.
Nella maggioranza dei casi però, il titolante non è disponibile sotto forma di standard primario. Si
utilizza allora una soluzione di titolante avente circa la concentrazione desiderata, per titolare una
massa nota di uno standard primario.
Con tale procedimento, detto standardizzazione, si determina l'esatta concentrazione della soluzione da utilizzare nell'analisi. Si dice allora che la soluzione è una soluzione standard. Se la soluzione standardizzata è usata per titolare una soluzione incognita, allora è detta standard secondario.
 |
| Appunti su: quando non puC3B2 essere stimato il punto equivalente3F, scelta di indicatore in funzione della forza dell acido, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |