 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1830 | Gradito: |
Leggi anche appunti:Relazione tra Keq ed E° per reazioni non-redoxRelazione tra Keq ed E° per reazioni non-redox I potenziali standard di Il riempimento degli orbitaliIl riempimento degli orbitali Convenzionalmente ogni orbitale viene rappresentato Equilibri di complessazione e costante di formazione dei complessiEquilibri di complessazione e costante di formazione dei complessi. Gli elementi |
 |
 |
Tabella con i primi 100 elementi chimici
(Z = numero atomico = numero di protoni)
|
Elemento |
Simbolo |
Z |
|
Elemento |
Simbolo |
Z |
|
Idrogeno |
H |
|
Antimonio |
Sb |
|
|
|
Elio |
He |
|
Tellurio |
Te |
|
|
|
Litio |
Li |
|
Iodio |
I |
|
|
|
Berillio |
Be |
|
Xeno |
Xe |
|
|
|
Boro |
B |
|
Cesio |
Cs |
|
|
|
Carbonio |
C |
|
Bario |
Ba |
|
|
|
Azoto |
N |
|
Lantanio |
La |
|
|
|
Ossigeno |
O |
|
Cerio |
Ce |
|
|
|
Fluoro |
F |
|
Praseodimio |
Pr |
|
|
|
Neon |
Ne |
|
Neodimio |
Nd |
|
|
|
Sodio |
Na |
|
Promezio |
Pm |
|
|
|
Magnesio |
Mg |
|
Samario |
Sm |
|
|
|
Alluminio |
Al |
|
Europio |
Eu |
|
|
|
Silicio |
Si |
|
Gadolinio |
Gd |
|
|
|
Fosforo |
P |
|
Terbio |
Tb |
|
|
|
Zolfo |
S |
|
Disprosio |
Dy |
|
|
|
Cloro |
Cl |
|
Olmio |
Ho |
|
|
|
Argon |
Ar |
|
Erbio |
Er |
|
|
|
Potassio |
K |
|
Tullio |
Tm |
|
|
|
Calcio |
Ca |
|
Itterbio |
Yb |
|
|
|
Scandio |
Sc |
|
Lutezio |
Lu |
|
|
|
Titanio |
Ti |
|
Afnio |
Hf |
|
|
|
Vanadio |
V |
|
Tantalio |
Ta |
|
|
|
Cromo |
Cr |
|
Tungsteno (Wolframio) |
W |
|
|
|
Manganese |
Mn |
|
Renio |
Re |
|
|
|
Ferro |
Fe |
|
Osmio |
Os |
|
|
|
Cobalto |
Co |
|
Iridio |
Ir |
|
|
|
Nichel |
Ni |
|
Platino |
Pt |
|
|
|
Rame |
Cu |
|
Oro |
Au |
|
|
|
Zinco |
Zn |
|
Mercurio |
Hg |
|
|
|
Gallio |
Ga |
|
Tallio |
Tl |
|
|
|
Germanio |
Ge |
|
Piombo |
Pb |
|
|
|
Arsenico |
As |
|
Bismuto |
Bi |
|
|
|
Selenio |
Se |
|
Polonio |
Po |
|
|
|
Bromo |
Br |
|
Astato |
At |
|
|
|
Kripton |
Kr |
|
Radon |
Rn |
|
|
|
Rubidio |
Rb |
|
Francio |
Fr |
|
|
|
Stronzio |
Sr |
|
Radio |
Ra |
|
|
|
Ittrio |
Y |
|
Attinio |
Ac |
|
|
|
Zirconio |
Zr |
|
Torio |
Th |
|
|
|
Niobio |
Nb |
|
Protoattinio |
Pa |
|
|
|
Molibdeno |
Mo |
|
Uranio |
U |
|
|
|
Tecnezio |
Tc |
|
Nettunio |
Np |
|
|
|
Rutenio |
Ru |
|
Plutonio |
Pu |
|
|
|
Rodio |
Rh |
|
Americio |
Am |
|
|
|
Palladio |
Pd |
|
Curio |
Cm |
|
|
|
Argento |
Ag |
|
Berkelio |
Bk |
|
|
|
Cadmio |
Cd |
|
Californio |
Cf |
|
|
|
Indio |
In |
|
Einstenio |
Es |
|
|
|
Stagno |
Sn |
|
Fermio |
Fm |
|
Per gli elementi con numero atomico maggiore di 100 i nomi ed i simboli derivano direttamente dal numero atomico dell'elemento utilizzando le seguenti radici numeriche:
0=nil 1=un 2=bi 3=tri 4=quad 5=pent 6=hex 7=sept 8=oct 9=enn
Le radici sono sistemate in successione seguendo il numero atomico e terminando con il suffisso 'ium'. Il simbolo è formato dalle lettere iniziali delle radici numeriche che compongono il nome.
Es:
Atomo 104 0 4 suffisso
un nil quad ium
nome: Unnilquadium
simbolo: Unq
Eccezioni
nomi e simboli approvati
101 Mendelevio Md
102 Nobelio No
103 Laurenzio Lr
104 Rutherfordio Rf
nomi e simboli proposti
105 Dubnio Db
106 Seaborgio Sg
107 Bohrio Bh
108 Hassio Hs
109 Meitnerio Mt
Numero di ossidazione (nox) o stato di ossidazione (stox)
Si definisce numero di ossidazione o stato di ossidazione la carica, reale o formale, che acquista un atomo quando si assegnano convenzionalmente gli elettroni di legame all'atomo più elettronegativo.
La carica è reale nei composti ionici ed in tal caso coincide con il numero di cariche portate dallo ione.
Ad esempio nel cloruro di sodio NaCl, costituito da uno ione sodio Na+ e da uno ione cloro Cl-, il sodio presenta nox +1, mentre il cloro presenta nox -1.
La carica è formale nei composti covalenti. Ad esempio nell'acqua H2O, gli elettroni di legame vengono assegnati all'ossigeno più elettronegativo, il quale assume perciò convenzionalmente 2 cariche negative e presenta nox -2. Ciascuno dei due idrogeni presenta quindi nox +1.
+4
Il numero di ossidazione si scrive sopra il simbolo chimico sotto forma di numero relativo Pb
Lo stato di ossidazione si scrive ad esponente del simbolo chimico o racchiuso tra parentesi tonde come numero romano PbIV Pb(IV)
Ciascun elemento chimico può presentare più di un numero di ossidazione. Vengono date di seguito alcune regole per l'attribuzione dei numeri di ossidazione.
1) il nox delle sostanze elementari (H2, O2, Na, Cu etc) è sempre zero poiché ci troviamo di fronte ad atomi di uno stesso elemento, aventi perciò la stessa elettronegatività.
Più in generale quando in una molecola due atomi di uno stesso elemento si uniscono con legame covalente, gli elettroni di legame non vanno attribuiti a nessuno dei due atomi.
2) Il nox di uno ione è pari alla sua carica
Ca2+ (nox +2) Al3+ (nox +3) S2- (nox -2)
3) L'idrogeno presenta sempre nox +1 tranne che quando si lega direttamente con metalli più elettropositivi (idruri), ed in cui ha dunque nox -1.
4) L'ossigeno ha sempre nox -2 tranne quando forma un legame covalente puro con se stesso (perossidi -O-O-) dove presenta nox -1. (secondo quanto previsto dalla regola numero 1 gli elettroni del legame tra atomi uguali non vanno attribuiti, mentre viene attribuito all'ossigeno l'altro elettrone utilizzato per legarsi ad altri elementi)
5) il fluoro, essendo l'elemento più elettronegativo della tabella periodica, ed avendo bisogno di un solo elettrone per raggiungere l'ottetto, ha sempre nox -1
6) Gli altri elementi del VII gruppo A hanno anch'essi nox -1, tranne quando si legano con elementi più elettronegativi, come ad esempio l'ossigeno, in tal caso presentano nox positivi.
7) In generale il nox più elevato di un elemento corrisponde al numero d'ordine del gruppo cui appartiene. Così gli elementi del primo gruppo presentano nox +1, quelli del secondo +2, quelli del terzo +3 e così via fino agli elementi del settimo gruppi che presentano come nox più elevato +7.
8) sempre in generale, quando un elemento presenta più di un nox, il valore di quest'ultimo diminuisce di 2 unità alla volta.
Così gli elementi del VII gruppo oltre al nox +7 possono presentare nox +5, +3, +1, -1.
gli elementi del VI gruppo oltre al nox + 6 possono presentare nox +4, +2, -2.
9) In una specie chimica neutra la somma dei nox di tutti gli atomi che la compongono deve sempre essere nulla.
10) In uno ione poliatomico la somma dei nox dei diversi atomi deve sempre essere pari alla carica totale dello ione.
Le ultime due regole ci permettono, partendo da una formula chimica, di calcolare il numero di ossidazione incognito della maggior parte degli elementi.
Ad esempio per calcolare il numero di ossidazione dello zolfo nell'anidride solforosa SO2, procediamo come segue: ciascun atomo di ossigeno presenta nox -2; complessivamente i due atomi presentano nox -4; affichè la somma dei nox sia zero lo zolfo deve presentare nox + 4.
Calcoliamo il nox del carbonio nello ione poliatomico HCO3-: i tre atomi di ossigeno presentano complessivamente nox - 6, l'idrogeno presenta nox + 1. Sommando il nox dei tre atomi di ossigeno e dell'idrogeno si ottiene - 5. Affinchè la somma di tutti i nox dia la carica complessiva dello ione -1, il carbonio deve presentare nox +4.
Nomenclatura tradizionale e nomenclatura sistematica (IUPAC)
La nomenclatura ha origine dalla distinzione degli elementi in metalli e non metalli. Da qui si fanno derivare due serie parallele di composti (serie basica e serie acida).
![]()
![]()
Metallo Ossido (basico) Idrossido (base)
![]()
![]()
non Metallo Anidride (Ossido acido) Acido (Ossiacido)
Dalla reazione di un composto della serie acida con un composto della serie basica si ottengono poi i sali
La nomenclatura tradizionale si basa sull'uso di prefissi e suffissi correlati allo stato di ossidazione degli atomi.
La nomenclatura IUPAC si basa invece per lo più sulla stechiometria della molecola ed ha l'obiettivo di rendere immediatamente evidenti il numero di atomi o gruppi chimici presenti in una molecola, facendoli precedere da opportuni prefissi moltiplicativo (che coincidono ovviamente con il loro indice).
Nella tabella seguente sono riportati i prefissi moltiplicativi
|
1 mono |
11 undeca |
21 henicosa |
31 hentriaconta |
50 pentaconta |
600 esacta |
|
2 di (bis) |
12 dodeca |
22 docosa |
32 dotriaconta |
60 hexaconta |
700 eptacta |
|
3 tri (tris) |
13 trideca |
23 tricosa |
33 tritriaconta |
70 heptaconta |
800 octacta |
|
4 tetra (tetrakis) |
14 tetradeca |
24 tetracosa |
34 tetratriaconta |
80 octaconta |
900 nonacta |
|
5 penta (pentakis) |
15 pentadeca |
25 pentacosa |
35 pentatriaconta |
90 nonaconta |
1000 kilia |
|
6 esa (esakis) |
16 esadeca |
26 esacosa |
36 esatriaconta |
100 ecta |
2000 dilia |
|
7 epta (eptakis) |
17 eptadeca |
27 eptacosa |
37 eptatriaconta |
200 dicta |
3000 trilia |
|
8 octa (octakis) |
18 octadeca |
28 octacosa |
38 octatriaconta |
300 tricta |
4000 tetrilia |
|
9 nona (nonakis) |
19 nonadeca |
29 nonacosa |
39 nonatriaconta |
400 tetracta |
5000 pentilia |
|
10 deca (decakis) |
20 icosa |
30 triaconta |
40 tetraconta |
500 pentacta |
10000 miria |
(octa=otta, epta=etta)
Nome di un elemento o sostanza elementare.
Nella nomenclatura sistematica (IUPAC) al nome dell'elemento si aggiunge l'appropriato prefisso numerico
nome sistematico nome tradizionale
H monoidrogeno idrogeno atomico
N monoazoto azoto atomico
N2 diazoto azoto
O monoossigeno ossigeno atomico
O2 diossigeno ossigeno
O3 triossigeno ozono
S6 esazolfo
Ar argon argon
Il prefisso mono si usa solo quando l'elemento non esiste nello stato monoatomico.
Regole per la costruzione dei composti binari
I composti binari sono formati da due soli elementi chimici.
Convenzionalmente si scrivono ponendo per primo l'elemento meno elettronegativo, seguito dall'elemento più elettronegativo.
Vi sono comunque eccezioni a tele regola di cui diremo
Il simbolo di ciascun elemento è seguito da un numero a pedice, detto indice, che indica quanti atomi di quell'elemento sono presenti nel composto.
Gli indici sono apposti in modo tale che, sommando i rispettivi nox, la molecola risulti neutra.
Per calcolare gli indici in modo semplice è sufficiente utilizzare il nox del primo elemento come indice del secondo e viceversa.
Ad esempio se vogliamo scivere la formula di un composto binario formato da un elemento A il cui numero di ossidazione sia +2 e da un composto B il cui numero di ossidazione sia -3, otterremo
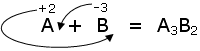
Si noti che l'elemento con il numero di ossidazione negativo (il più elettronegativo) è stato scritto per secondo.
Tale metodo di costruzione dei composti binari garantisce la neutralità della molecola.
Infatti nella molecola sono presenti 3 atomi di A per un totale di 6 cariche positive e 2 atomi di B per un totale di 6 cariche negative.
Qualora dopo aver calcolato gli indici questi risultino divisibili per uno stesso numero, gli indici vanno semplificati, tranne alcuni casi particolari (vedi ad esempio alcuni perossidi).
Fanno eccezione alcuni composti, la cui formula è necessario conoscere, come ad esempio il perossido di idrogeno, H2O2, in cui gli indici non vanno semplificati.
A - Composti della serie basica (ossidi ed idrossidi)
A.1 Ossidi (ossidi basici)
Sono composti in cui un metallo si lega con l'ossigeno (nox -2).
Metallo + O2 ossido
La formula generale di un ossido è Me2On con n = nox del metallo (Me)
La nomenclatura tradizionale degli ossidi prevede:
Se il metallo presenta un unico stato di ossidazione il composto si chiamerà "Ossido di" seguito dal nome del metallo
Se il metallo presenta due stati di ossidazione forma con l'ossigeno due tipi di ossidi. Nel composto a nox maggiore il metallo prende la desinenza -ico, in quello a nox minore prende la desinenza -oso.
La nomenclatura sistematica (IUPAC) degli ossidi prevede:
la denominazione "ossido di" seguita dal nome del metallo, con l'utilizzo di opportuni prefissi moltiplicativi che precedono sia il termine "ossido" sia il nome del metallo. Nel caso il metallo presenti più di un numero di ossidazione è possibile far seguire al nome del metallo il suo stato di ossidazione in numero romano racchiuso tra parentesi tonde (notazione di Stock).
Il numero romano va letto come numero cardinale
Nome sistematico Nome tradizionale
MgO ossido di magnesio ossido di magnesio
Li2O Ossido di dilitio ossido di litio
Al2O3 triossido di dialluminio ossido di alluminio
PbO Ossido di Piombo (II) Ossido piomboso
PbO2 diossido di Piombo (IV) Ossido piombico
A.2 Idrossidi
Gli idrossidi si formano sommando una o più molecole d'acqua ad un'ossido
Ossido + nH2O Idrossido
Gli idrossidi hanno formula generale Me(OH)n con n pari al numero di ossidazione del metallo (Me). In altre parole Per costruire un idrossido è sufficiente far seguire al metallo tanti gruppi ossidrili o idrossidi (OH) quanti ne richiede il suo numero di ossidazione.
Ad esempio dall'ossido di potassio si ottiene l'idrossido di potassio
K2O + H2O 2KOH
mentre dall'ossido rameico si ottiene l'idrossido rameico
CuO + H2O Cu(OH)2
Nella nomenclatura tradizionale il nome degli idrossidi si ottiene da quello dell'ossido corrispondente, sostituendo il termine 'idrossido' al termine 'ossido'. Nella nomenclatura IUPAC il termine "idrossido" viene preceduto da opportuno prefisso moltiplicativo.
Nome sistematico Nome tradizionale
Mg(OH)2 diidrossido di magnesio idrossido di magnesio
LiOH idrossido di litio idrossido di litio
Al(OH)3 triidrossido di alluminio idrossido di alluminio
Pb(OH)2 diidrossido di piombo (II) idrossido piomboso
Pb(OH)4 tetraidrossido di piombo (IV) idrossido piombico
B - Composti della serie acida (anidridi ed ossiacidi).
B.1 Anidridi (ossidi acidi)
Sono composti in cui un non metallo si lega con l'ossigeno (nox -2).
non Metallo + O2 Anidridi
La formula generale di un'anidride è nMe2Ox con x = nox del non metallo (nMe)
La nomenclatura tradizionale degli anidridi prevede:
Se il non metallo presenta un unico stato di ossidazione il composto si chiamerà "Anidride" seguito dal nome del non metallo con desinenza -ica
Se il non metallo presenta due stati di ossidazione forma con l'ossigeno due tipi di anidridi. Nel composto a nox maggiore il non metallo prende la desinenza -ica, in quello a nox minore prende la desinenza -osa.
Se il non metallo presenta quattro stati di ossidazione forma con l'ossigeno quattro tipi di anidridi
Nel composto a nox maggiore il non metallo prende il prefisso per- e la desinenza -ica
nel composto a nox minore prende il prefisso ipo- e la desinenza -osa.
nei composti a nox intermedi si avranno le desinenze -ica (per il nox più elevato dei due) ed -osa (per il nox meno elevato dei due)
|
nox |
prefisso |
desinenza |
|||
|
|
per- |
-ica |
|||
|
|
-ica |
||||
|
|
-osa |
||||
|
ipo- |
-osa |
La nomenclatura sistematica (IUPAC) delle anidridi prevede:
la denominazione "ossido di" seguita dal nome del non metallo, con l'utilizzo di opportuni prefissi moltiplicativi che precedono sia il termine "ossido" sia il nome del non metallo. Nel caso il non metallo presenti più di un numero di ossidazione è possibile far seguire al nome del non metallo il suo stato di ossidazione in numero romano racchiuso tra parentesi tonde (notazione di Stock). Il numero romano va letto come numero cardinale
Nome sistematico Nome tradizionale
CO2 diossido di carbonio anidride carbonica
SO2 diossido di zolfo (IV) anidride solforosa
SO3 triossido di zolfo (VI) anidride solforica
Cl2O ossido di dicloro (I) Anidride ipoclorosa
Cl2O3 triossido di dicloro (III) anidride clorosa
Cl2O5 pentossido di dicloro (V) anidride clorica
Cl2O7 eptossido di dicloro (III) anidride perclorica
B.2 Ossiacidi o ossoacidi
Gli ossoacidi si formano sommando una o più molecole d'acqua ad un'anidride
anidride + nH2O Ossoacido
Nella nomenclatura tradizionale il nome degli acidi si ottiene da quello dell'anidride corrispondente, sostituendo il termine 'acido' al termine 'anidride'. La nomenclatura tradizionale prevede inoltre particolari prefissi per indicare acidi con diversi gradi di idratazione (metaacidi, ortoacidi), acidi condensati (diacidi triacidi .poliacidi), acidi con gruppi perossidi (perossiacidi)
La nomenclatura IUPAC prevede per tutti gli acidi la desinenza -ico ed opportuni prefissi moltiplicativi per indicare il numero di atomi di ossigeno (osso), di eventuali altri gruppi e del non metallo. Per gli acidi condensati in cui un ossigeno fa da ponte tra due molecole acide l'atomo-ponte viene preceduto dalla lettera greca m. Nel caso in cui il non metallo presenti più di un numero di ossidazione è possibile far seguire al nome del non metallo il suo stato di ossidazione in numero romano racchiuso tra parentesi tonde (notazione di Stock). Il numero romano va letto come numero cardinale.
In alternativa l'acido può essere visto come un sale di idrogeno. In questo caso prenderà la desinenza -ato e verrà specificato il numero di atomi di idrogeno tramite opportuno prefisso moltiplicativo
Per costruire un acido è sufficiente sommare all'anidride 2 atomi di idrogeno e 1 di ossigeno per ogni molecola d'acqua che viene aggiunta.
Ad esempio dall'anidride carbonica si ottiene l'acido carbonico
CO2 + H2O H2CO3
mentre dall'anidride nitrica si ottiene l'acido nitrico
N2O5 + H2O H2N2O6 2HNO3
Alcuni acidi si presentano in diversi gradi di idratazione. Ad esempio, sommando un'altra molecola d'acqua all'acido fosforico si ottiene l'acido ortofosforico. La forma meno idratata prende il nome di acido metafosforico
P2O5 + H2O 2HPO3 (acido metafosforico)
HPO3 + H2O H3PO4 (acido ortofosforico)
Alcuni acidi, come l'acido fosforico, possono dare reazioni di condensazione con perdita di molecole d'acqua
H3PO4 + H3PO4 H2O + H4P2O7 (acido difosforico o pirofosforico)
Esistono infine i cosiddetti perossiacidi, come l'acido perossifosforico (perfosforico) H3PO5 che contengono un gruppo perossido (-O-O-)
Nome sistematico Nome tradizionale
H2CO3 acido triossocarbonico acido carbonico
triossocarbonato di diidrogeno
H2SO3 acido triossosolforico (IV) acido solforoso
triossosolfato (IV) di diidrogeno
H2SO4 acido tetraossosolforico (VI) acido solforico
tetraossosolfato (VI) di diidrogeno
HClO acido monossoclorico (I) acido ipocloroso
monossoclorato (I) di idrogeno
HClO2 acido diossoclorico (III) acido cloroso
diossoclorato (III) di idrogeno
HClO3 acido triossoclorico (V) acido clorico
triossoclorato (V) di idrogeno
HClO4 acido tetraossoclorico (III) acido perclorico
tetraossoclorato (III) di idrogeno
HPO3 acido triossofosforico (V) acido metafosforico
triossofosfato (V) di idrogeno
H3PO4 acido tetraossofosforico (V) acido ortofosforico
tetraossofosfato (V) di triidrogeno
H4P2O7 acido m-osso esaossodifosforico (V) acido pirofosforico
m-osso esaossodifosfato (V) di tetraidrogeno
H3PO5 acido perossotriossofosforico (V) acido perossifosforico
perossotriossofosfato (V) di triidrogeno
H4P2O8 acido m-perosso esaossodifosforico (V) acido diperossifosforico
m-perosso esaossodifosfato (V) di tetraidrogeno
ossoacidi sostituiti
Gli acidi ottenuti formalmente per sostituzione di tutti o parte degli atomi di ossigeno con altri gruppi mantengono la stessa nomenclatura dell'acido di partenza. I nuovi gruppi introdotti vanno ovviamente citati (gli atomi di zolfo che sostituiscono l'ossigeno vengono indicati con il prefisso "tio").
H2S2O3 triossotiosolfato (VI) di idrogeno
H2CS3 tritiocarbonato di diidrogeno
H[PF6] esafluorofosfato (V) di idrogeno
H2[PtCl4] tetracloroplatinato (II) di idrogeno
H4[Fe(CN)6] esacianoferrato (II) di tetraidrogeno
Anche gli acidi ottenuti formalmente per sostituzione di gruppi idrossidi con altri gruppi
mantengono la stessa nomenclatura dell'acido di partenza
HSO3Cl clorotriossosolfato di idrogeno
HSO3NH2 amidetriossosolfato di idrogeno
C - I Sali degli ossoacidi
I Sali degli ossoacidi derivano formalmente dalla sostituzione di uno o più ioni H+ degli ossoacidi con cationi. Si possono formare sia utilizzando un anione proveniente da un acido completamente dissociato, ed in tal caso sono detti Sali neutri, sia da un acido parzialmente dissociato. In tal caso l'anione possiede ancora atomi di idrogeno nella sua molecola e il sale che si forma è detto sale acido. (monoacido se conserva un idrogeno, biacido se ne conserva due etc)
Ad esempio l'acido ortofosforico può formare tre tipi di Sali utilizzando gli anioni provenienti dalle tre dissociazioni successive
H3PO4 H+ + H2PO4- anione biacido
H2PO4- H+ + HPO42- anione monoacido
HPO42- H+ + PO43- anione neutro
Nella nomenclatura tradizionale i nomi dei Sali si formano da quelli degli acidi corrispondenti cambiando le desinenze secondo lo schema seguente
oso ito
ico ato
ed eventualmente usando i termini "monoacido" "biacido" etc per i Sali acidi
La nomenclatura IUPAC prevede per tutti i Sali la desinenza -ato ed opportuni prefissi moltiplicativi per indicare il numero di atomi di ossigeno (osso) e di eventuali altri gruppi. Se è necessario un prefisso moltiplicativo per un costituente che a sua volta inizia con un prefisso moltiplicativo, il costituente va messo fra parentesi ed il prefisso utilizzato è quello indicato, fra parentesi, nella Tabella dei prefissi moltiplicativi (bis, tris, tetrakis..)
Nome sistematico Nome tradizionale
CaSO3 triossosolfato (IV) di calcio solfito di calcio
CuSO4 tetraossosolfato (VI) di rame (II) solfato rameico
Na2SO4 tetraossosolfato (VI) di sodio solfato di sodio
Fe(NO2)2 bis(diossonitrato) (III) di Ferro (II) nitrito ferroso
NaNO3 triossonitrato (V) di sodio nitrato di sodio
Na3PO4 tetraossofosfato (V) di trisodio ortofosfato di sodio
NaHSO3 idrogeno triossosolfato (IV) di sodio solfito monoacido di sodio
(bisolfito di sodio)
CuH2PO4 diidrogeno tetraossofosfato (V) di rame (I) fosfato biacido rameoso
NaHCO3 idrogeno triossocarbonato (IV) di sodio carbonato monoacido di sodio
(bicarbonato di sodio)
Pb(ClO)4 tetrakis(monossoclorato) (I) di Piombo (IV) ipoclorito piombino
Fe(OH)ClO ossoclorato (I) di idrossiferro (II) ipoclorito monobasico ferroso
Fe(MnO4)3 tris(tetraossomanganato) (VII) di ferro (III) permanganato ferrico
D - Composti binari dell'idrogeno (idracidi ed idruri)
D.1 Idruri
Gli Idruri sono i composti che l'idrogeno forma con elementi meno elettronegativi, in cui presenta pertanto nox -1 (ione idruro H-) e quindi nella formula va scritto per secondo.
Gli idruri hanno formula generale XHn con n = nox dell'elemento X
La nomenclatura tradizionale e IUPAC coincidono per gli idruri. Il loro nome è formato dal termine 'idruro di' seguito dal nome dell'elemento. La nomenclatura IUPAC prevede naturalmente l'uso di opportuni prefissi moltiplicativi
Nome sistematico Nome tradizionale
KH idruro di potassio idruro di potassio
MgH2 diidruro di magnesio idruro di magnesio
BH3 triidruro di boro idruro di boro
NH3 triidruro di azoto* ammoniaca*
PH3 triidruro di fosforo fosfina
AsH3 triidruro di arsenico arsina
SbH3 triidruro di antimonio stibina
In realtà l'azoto è più elettronegativo dell'idrogeno ed il composto andrebbe scritto H3N (nitruro di idrogeno), ma l'ammoniaca presenta comunque carattere basico e si conviene dunque di non scrivere gli idrogeni per primi, come avviene per gli idracidi
Una nomenclatura alternativa per gli idruri, utilizzata soprattutto quando questi si comportano come gruppi sostituenti in molecole organiche, prevede la desinenza -ano (in analogia con il metano CH4).
BH3 borano
SiH4 silano
GeH4 germano
SnH4 stannano
PbH4 piombano
NH3 azano (ammoniaca)
PH3 fosfano (fosfina)
AsH3 arsano (arsina)
SbH3 stibano (stibina)
BiH3 bismutano
OH2 ossidano (acqua)
SH2 solfano (solfuro di idrogeno)
SeH2 selano
TeH2 tellano
PoH2 pollano
In assenza di indicazioni l'elemento esibisce il suo numero standard di legami. Nel caso di un numero diverso di legami, questo numero deve essere indicato ad esponente della lettera lambda, la quale precederà il nome dell'idruro, separata da un trattino
PH5 l -fosfano
SH6 l -solfano
D.2 Idracidi
Gli idracidi sono i composti che l'idrogeno forma con elementi più elettronegativi, in cui presenta pertanto nox +1 (H+ presenta carattere acido) e quindi nella formula va scritto per primo. I principali idracidi si formano dall'unione dell'idrogeno con i non metalli del VII gruppo A (alogeni) e con i non metalli del VI gruppo A.
Gli idracidi hanno formula generale HnX con n = nox dell'elemento X
Nella nomenclatura tradizionale Il nome degli idracidi si forma facendo seguire al termine 'acido' il nome del non metallo seguito dalla desinenza -idrico.
Nella nomenclatura IUPAC l'idracido è trattato come un composto binario privo di ossigeno. L'elemento più elettronegativo prende la desinenza -uro, seguito dalla termine "di idrogeno" (eventualmente con gli opportuni prefissi moltiplicativi
Nome sistematico Nome tradizionale
HF fluoruro di idrogeno acido fluoridrico
HCl cloruro di idrogeno acido cloridrico
HBr bromuro di idrogeno acido bromidrico
HI ioduro di idrogeno acido Iodidrico
H2S solfuro di diidrogeno acido solfidrico
H2Se seleniuro di diidrogeno acido selenidrico
H2Te tellururo di diidrogeno acido telluridrico
Altri idracidi sono
HCN H CsN cianuro di idrogeno acido cianidrico
HN3 H N NsN azoturo di idrogeno acido azotidrico
E - Composti binari senza ossigeno
I composti binari prendono il nome dall'elemento più elettronegativo il quale prende la desinenza -uro. La tabella seguente riporta i principali anioni monoatomici ed omopoliatomici che compaiono in seconda posizione nei composti binari senza ossigeno
H- idruro
F- fluoruro
Cl- cloruro
Br- bromuro
I- ioduro
At- astaturo
S2- solfuro
Se2- selenuro
Te2- tellururo
N3- nitruro
P3- fosfuro
As3- arsenuro
Sb3- antimonuro
C4- carburo
Si4- siliciuro
B3- boruro
Al3- alluminuro
Na- natruro
Au- aururo
K- caluro
O3- ozonuro
N3- azoturo
C22- acetiluro
S22- disolfuro
Fanno eccezione, come abbiamo detto, gli anioni dell'ossigeno
O2- ossido
O2- superossido
O22- perossido
Nome sistematico Nome tradizionale
SiC Carburo di silicio Carburo di silicio
SbAs Arsenuro di antimonio (III) Arsenuro antimonioso
Si3N4 Tetranitruro di trisilicio nitruro di silicio
AsH3 Triidruro di arsenico (III) idruro arsenioso
OF2 difluoruro di ossigeno fluoruro di osssigeno
ICl Cloruro di iodio cloruro di iodio
SnCl2 dicloruro di stagno (II) Cloruro stannoso
SnCl4 tetracloruro di stagno (IV) Cloruro stannico
FeCl2 dicloruro di ferro (II) Cloruro ferroso
FeCl3 tricloruro di ferro (III) Cloruro ferrico
AlN Nitruro di alluminio Nitruro di alluminio
CdSe Selenuro di cadmio Selenuro di cadmio
F - cationi poliatomici ottenuti per addizione di H+
I cationi poliatomici ottenuti per addizione di ioni H+ prendono la desinenza -onio
H3O+ ossonio
NH4+ ammonio
PH4+ fosfonio
AsH4+ arsonio
SbH4+ stibonio
H3S+ solfonio
H3Se+ selenonio
H2F+ fluoronio
H2Cl+ cloronio
H2Br+ bromonio
H2I+ iodonio
Nomenclatura complessi
I metalli di transizione, che allo stato elementare possiedono livelli d o f parzialmente occupati, formano una vasta classe di composti, detti complessi o composti di coordinazione. in cui il metallo centrale M (allo stato neutro o ionizzato) forma legami covalenti dativi (o di coordinazione) con una serie di atomi o gruppi chimici, detti leganti (o ligandi, italianizzando il termine inglese 'ligands'), neutri o di carica opposta rispetto all'atomo centrale. Il metallo centrale agisce come acido di Lewis (accettore di elettroni, elettrofilo) nei confronti dei leganti che si comportano come basi di Lewis (donatori di doppietti elettronici, nucleofili).
Un complesso può risultare neutro od elettricamente carico (ione complesso); ovviamente la sua carica sarà data dalla somma delle cariche del metallo centrale e dei leganti. La formula di un complesso viene racchiusa tra parentesi quadre, scrivendo prima il metallo centrale e poi i leganti. Negli esempi seguenti indichiamo con M il metallo centrale e con L i leganti
catione complesso [Co(NH3)6]3+ (M = Co3+, L = 6 NH3)
anione complesso [PtCl6]2 - (M = Pt4+, L = 6 Cl-)
complesso neutro [Fe3 (CO)12] (M = 3 Fe, L = 12 CO)
complesso neutro [Cr(H2O)3Cl3] (M = Cr3+, L = 3 H2O, L = 3 Cl-)
Nel nome del complesso vengono invece indicati per prima i leganti e per ultimo il metallo (atomo centrale), secondo le seguenti regole.
[NiCl4]2- tetracloronichelato(II)
[Ni(PPh3)4] tetrakis(trifenilfosfina)nichel(0)
[Co(en)3]3+ tris(etilendiammina)cobalto(III)
|
Leganti anionici |
Leganti neutri |
||
|
F- |
Fluoro |
H2O |
Acquo |
|
Cl- |
Cloro |
NH3 |
Ammino |
|
Br- |
Bromo |
CO |
Carbonil |
|
I- |
Iodo |
NO |
Nitrosil |
|
H- |
Idrogeno (Idruro) |
N2 |
diazoto |
|
:CN- |
Ciano |
O2 |
diossigeno |
|
OH- |
Idrosso |
en |
etilendiamina |
|
CO32- |
Carbonato |
dien |
dietilentriamina |
|
C2O42- (Ox) |
Ossalato |
trien |
trietilentetraamina |
|
:SCN- |
Tiocianato |
py |
piridina |
|
:NCS- |
Isotiocianato |
bpy (bipy) |
bipiridina |
|
O2- |
Osso (Oxo) |
terpy |
terpiridina |
|
O22- |
Perosso |
PH3 |
fosfina |
|
O2- |
Superosso |
PPh3 |
trifenilfosfina |
|
EDTA4- |
etilendiamminotetraacetato |
PMe3 |
trimetilfosfina |
|
acac- |
acetilacetonato |
PEt3 |
trietilfosfina |
|
CH3- (Me) |
metil |
PF3 |
trifluorofosfina |
|
CH3CH2- (Et) |
etil |
NH2Me |
metilamina |
|
NO2- |
nitrito |
difos |
difosfano |
|
SO32- |
solfito |
diars |
diarsano |
|
Ph- |
fenil |
glime |
glicodimetiletere |
|
CH3COO- (MeCOO-) |
acetato (etanoato) |
|
urea |
|
gly- |
glicinato |
C2H4 |
etene |
|
sal- |
salicilato |
CH3CN |
acetonitrile |
|
C5H5- |
ciclopentadienil |
|
|
|
N3- |
azido (azoturo) |
|
|
|
N3- |
nitruro |
|
|
NH3 = ammino NH2 = amina (o ammina)
I complessi in cui il metallo centrale lega un solo tipo di leganti sono detti omolettici ( ad esempio esaamminocobalto(III) [Co(NH3)6]3+), quelli in cui il metallo si lega a gruppi diversi (ad esempio tetraamminodiclorocobalto(III) [Co(NH3)4Cl2]+) sono detti eterolettici.
I leganti vengono classificati in relazione al numero di doppietti elettronici (e quindi di legami) che possono utilizzare per legarsi all'atomo centrale. Se un legante forma un solo legame con l'atomo centrale il legante si dice monodentato (CO, NH3, CN-, OH-, H2O etc), se ne forma due si dice bidentato (dien, en, acac.) e così via. I leganti polidentati si definiscono agenti chelanti ed i complessi che presentano leganti polidentati si definiscono anche composti chelati.
Un complesso chelato risulta più stabile di un analogo complesso contenente solo leganti monodentati. Tale aumento di stabilità è noto come effetto chelato.
 |
| Appunti su: |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |