 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2816 | Gradito: |
Leggi anche appunti:Legge di Dalton o delle pressioni parzialiLegge di Dalton o delle pressioni parziali Quando due o più gas vengono Sintesi di 1,10-fenantrolina -5,6- dioneSintesi di 1,10-fenantrolina -5,6- dione La molecola 1,10-fenantrolina-5,6-dione, pH in soluzioni di acidi e basi deboli: ka e kb (pka e pkb)pH in soluzioni di acidi e basi deboli: ka e kb (pka e pkb) Per il calcolo |
 |
 |
Convenzionalmente ogni orbitale viene rappresentato mediante un quadrato all'interno del quale è possibile disporre fino ad un massimo di due elettroni rappresentabili mediante frecce verticali con verso opposto, ad indicare lo spin antiparallelo.

vuoto semisaturo saturo
(elettrone spaiato)
Ciascun orbitale viene poi indicato con una sigla composta da un numero da 1 a 7 che indica il livello energetico seguito da una lettera (s, p, d, f) che indica il tipo di orbitale. Ad esempio 1s rappresenta l'unico orbitale s del primo livello energetico; 2p indica i tre orbitali p del secondo livello energetico; 6d i cinque orbitali d del sesto livello energetico.
Dato un elemento di numero atomico Z, è possibile distribuire correttamente i suoi Z elettroni nei diversi orbitali seguendo le seguenti tre regole di riempimento (Regole di Aufbau):
Gli elettroni si dispongono spontaneamente negli orbitali vuoti meno energetici. Una volta riempiti gli orbitali a minor energia vengono occupati gradualmente gli orbitali ad energia progressivamente maggiore. L'ordine di riempimento ottenuto in tal modo non rispetta però sempre l'ordine di riempimento che ci si attenderebbe in base alla sequenza ordinata dei livelli energetici.
Il contenuto energetico degli orbitali è riportato nello schema seguente, in cui ogni orbitale è rappresentato come un quadrato.
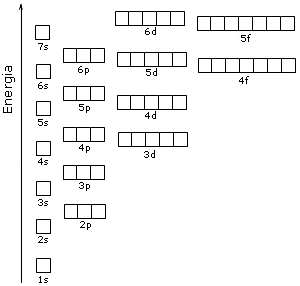
Come conseguenza di tale struttura energetica l'ordine di riempimento degli orbitali in funzione del loro contenuto energetico risulta essere quello che si ottiene seguendo le diagonali dello schema seguente.
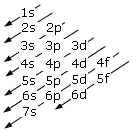
E dunque
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d
Ogni orbitale può contenere al massimo 2 elettroni i quali saturano l'orbitale disponendosi con spin controversi (antiparalleli). Lo spin (momento angolare intrinseco) è una caratteristica vettoriale degli elettroni (gli elettroni si comportano come minuscole trottole che ruotano attorno al proprio asse e quindi possiedono un momento angolare). Un elettrone può possedere solo due valori di spin (anche lo spin è quantizzato). Gli elettroni negli orbitali vengono rappresentati con delle frecce verticali (che rappresentano il vettore spin).
Rappresentando dunque gli orbitali come quadrati o, come spesso si usa, come linee orizzontali, si possono presentare 3 situazioni
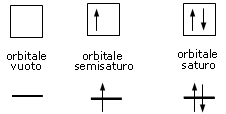
Un orbitale saturo presenta i due elettroni con spin antiparalleli (↑↓)
Gli elettroni si dispongono negli orbitali degeneri uno per orbitale con spin parallelo fino a semisaturarli tutti e, successivamente, li saturano seguendo il principio di esclusione Pauli. Così, se dobbiamo inserire 3 elettroni nei tre orbitali degeneri 2p, otterremo la seguente configurazione
![]() e non
e non ![]()
Esatto Errato!!
O, dovendo inserire 7 elettroni nei cinque orbitali degeneri 4d, si otterrà
![]() e non
e non ![]()
Esatto Errato!!
Applicando dunque le 3 regole di Aufbau possiamo ottenere la configurazione elettronica dell'Ossigeno (Z = 8). I suoi 8 elettroni si distribuiranno secondo il seguente schema
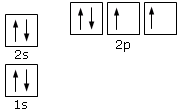
La configurazione elettronica dell'Ossigeno può essere riassunta in modo sintetico scrivendo gli elettroni ad esponente degli orbitali che li contengono
1s2 2s2 2p4
in cui i numeri ad esponente indicano quanti elettroni sono sistemati in quei particolari orbitali.
 |
| Appunti su: |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |