 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2175 | Gradito: |
Leggi anche appunti:Legge delle proporzioni multiple (Dalton 1803)Legge delle proporzioni multiple (Dalton 1803) Quando due elementi si combinano Il 1918 la scoperta della sintesi dell'ammoniacaIl 1918 la scoperta della sintesi dell'ammoniaca Il 1918 lo studioso tedesco Il sistema periodico degli elementiIL SISTEMA PERIODICO DEGLI ELEMENTI Nel 1869 Mendeleev ordinò gli elementi |
 |
 |
Quando due o più gas vengono mescolati in un recipiente, senza che tra essi avvenga alcuna reazione, la pressione totale esercitata dalla miscela gassosa è uguale alla somma delle pressioni che ciascun componente la miscela eserciterebbe se occupasse da solo tutto il recipiente (pressione parziale del componente).
![]()
La pressione parziale di un generico componente imo sarà pari a
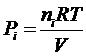
Ciascun componente gassoso si comporta dunque come fosse da solo e contribuisce alla pressione totale in proporzione al suo numero di moli.

Se in un recipiente vi sono n1 moli del gas 1, n2 moli del gas 2,..nn moli del gas n, l'effetto complessivo sarà equivalente alla presenza di n1+ n2 ++ nn= n moli di un unico gas nel recipiente.
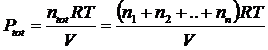

Dividendo membro a membro l'equazione di stato di ciascun componente per l'equazione di stato della miscela si ottiene

dalla quale si ricava la seguente relazione alternativa per la legge di Dalton, valida per un generico componente imo

dove il rapporto ![]() è detto frazione molare del componente imo.
è detto frazione molare del componente imo.
La legge di Dalton si esprime quindi anche dicendo che 'la pressione parziale di un componente gassoso è pari al prodotto tra la sua frazione molare e la pressione totale della miscela'.
Si noti che la somma di tutte le frazioni molari deve sempre necessariamente essere pari all'unità.
 |
| Appunti su: |
|
| Appunti Biologia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Geografia |  |