 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3689 | Gradito: |
Leggi anche appunti:Metabolismo catabolico dei cibiMetabolismo catabolico dei cibi Il Coenzima A veicola il gruppo Calcolo del pH di acidi e basi deboli molto diluiti e/o molto deboliCalcolo del pH di acidi e basi deboli molto diluiti e/o molto deboli Quando Impianto a BiogasImpianto a Biogas Biogas Con il termine biogas si intende una miscela |
 |
 |
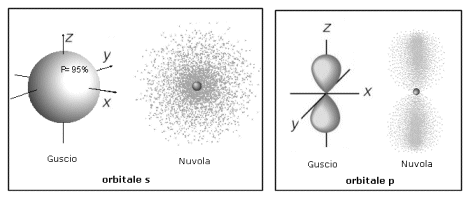
Gli elettroni orbitano intorno al nucleo secondo schemi particolari, scoperti solamente nella prima metà del Novecento. Inizialmente si riteneva che gli elettroni percorressero traiettorie definite all'interno di orbite circolari ed ellittiche. Successivamente si è scoperto che è impossibile definire con precisione la traiettoria di un elettrone ed il concetto di orbita è stato sostituito dal concetto di orbitale. L'orbitale è la regione di spazio intorno al nucleo alla quale si associa una certa probabilità, arbitrariamente fissata (in genere del 90-95%) di trovare l'elettrone. Gli orbitali vengono rappresentati tramite gusci delimitati da superfici chiuse o tramite nuvole sfumate (nuvola elettronica) la cui intensità di colore è proporzionale alla probabilità di trovare l'elettrone. Vi sono 4 tipi di orbitali di forma diversa, indicati con le lettere s, p, d, f. Gli orbitali s sono sferici, gli orbitali p sono bilobati, mentre gli orbitali d ed f hanno complesse forme multilobate.
Ogni orbitale può contenere al massimo due elettroni.
Gli elettroni possono sistemarsi solo a certe distanze dal nucleo, formando così una sorta di strati o gusci elettronici, a ciascuno dei quali compete una certa energia caratteristica, detta livello energetico. I livelli energetici sono quantizzati, possono cioè possedere solo certi valori di energia. Ogni livello energetico può contenere solo un certo numero di elettroni, caratteristico del livello. Gli elettroni tendono ad occupare sempre il livello energetico libero più basso (più vicino al nucleo) fino a saturarlo e solo allora si dispongono in livelli energetici più esterni.
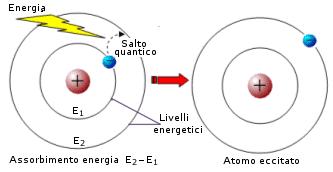
Un elettrone può passare da un livello più interno di energia Ei ad uno più esterno libero di energia Ee, solo se gli viene fornita esattamente la quantità di energia Ee-Ei. In altre parole se sono quantizzati i livelli energetici, allora sono quantizzate anche le differenze di energia tra i livelli (dislivelli energetici quantizzati). Ciò significa che ogni atomo può assorbire solo certe quantità di energia caratteristiche. Come abbiamo appena detto, quando un atomo assorbe energia un elettrone passa da un livello più interno ad uno più esterno (salto quantico o transizione elettronica) e l'atomo si viene a trovare in una situazione di instabilità (stato eccitato). Quando l'elettrone ritorna al livello energetico di partenza, viene restituita esattamente la medesima quantità di energia assorbita e l'atomo riacquista stabilità (stato fondamentale).
Nel primo livello energetico, quello più vicino al nucleo, possono essere ospitati non più di 2 elettroni (vi è solo un orbitale s)
Nel secondo livello energetico altri 2 elettroni come in precedenza più altri 6. Si tratta in realtà di due sottolivelli il primo con 2 elettroni (1 orbitale s) ed il secondo con 6 elettroni (3 orbitali p) per un totale di 8 elettroni.
Nel terzo livello 2 + 6 + 10 elettroni (3 sottolivelli: 1 orbitale s + 3 orbitali p + 5 orbitali d) per un totale di 18 elettroni.
Nel quarto livello 2 + 6 + 10 + 14 elettroni (4 sottolivelli: 1 orbitale s + 3 orbitali p + 5 orbitali d + 7 orbitali f) per un totale di 32 elettroni.
I livelli successivi presentano al massimo 4 sottolivelli. Gli atomi più pesanti, come l'Uranio, hanno elettroni a sufficienza per occupare 7 livelli energetici, senza tuttavia riuscire a riempirli completamente.
Gli atomi utilizzano gli elettroni del loro livello energetico più esterno (elettroni superficiali o elettroni di valenza) per interagire tra loro. Il tipo di reazioni che possono fare dipende quindi dal numero di elettroni del loro strato di valenza o, come si usa dire, dalla loro configurazione elettronica superficiale. Atomi di elementi diversi che presentino la medesima configurazione elettronica superficiale (il medesimo numero di elettroni sul loro ultimo livello) manifestano quindi caratteristiche chimiche simili.
Così l'Idrogeno, il primo e più leggero degli elementi chimici é costituito di 1 protone nel nucleo e di un elettrone nel primo livello energetico.
L'Elio con 2 protoni + 2 neutroni nel nucleo e due elettroni orbitanti, satura il primo livello energetico.
Il Litio, che possiede 3 protoni, 3 neutroni e tre elettroni, sistema i primi due elettroni nel primo livello, saturandolo, ed é costretto a sistemare il suo terzo elettrone nel secondo livello. per questo motivo viene incolonnato sotto l'Idrogeno. Come l'idrogeno presenta infatti un unico elettrone sul livello energetico più superficiale.
L'elemento successivo, il Berillio (Be 4 elettroni), ne sistema 2 nel primo livello e 2 nel secondo.
Il Boro (B - 5 elettroni) ne sistema 2 nel primo e 3 nel secondo.
Il Carbonio (C - 6 elettroni) ne sistema 2 nel primo e 4 nel secondo.
L'Azoto (N - 7 elettroni) 2 nel primo e 5 nel secondo.
L'Ossigeno (O - 8 elettroni) 2 nel primo e 6 nel secondo.
il Fluoro (F - 9 elettroni) 2 nel primo e 7 nel secondo.
Il Neon (Ne - 10 elettroni), con 2 elettroni nel primo e 8 nel secondo, satura il secondo livello energetico. Quando un elemento chimico satura con 8 elettroni i primi due sottolivelli del suo ultimo livello risulta chimicamente stabile. In altre parole non manifesta alcuna tendenza a modificare la sua configurazione elettronica, tramite reazioni chimiche con altri atomi. Il Neon si trova in questa condizione.
Il Sodio (Na), che possiede 11 elettroni ne sistema 2 nel primo, 8 nel secondo e 1 nel terzo.
Il Sodio viene a possedere così un unico elettrone sul livello energetico più superficiale, come il Litio e l'Idrogeno e viene perciò incolonnato sotto di essi.
Il Magnesio (Mg) che possiede 12 elettroni ne sistema 2 nel primo livello, 8 nel secondo e 2 nel terzo. Possedendo 2 elettroni sul livello energetico più esterno, come il Berillio viene incolonnato sotto di esso.
Sotto il Magnesio, incolonnato nel suo stesso gruppo, troviamo il Calcio che dopo aver saturato di elettroni i primi tre livelli, presenta 2 elettroni nel quarto livello, quello più esterno e quindi presenta la stessa configurazione elettronica superficiale del Berillio e del Magnesio.
Tutti i successivi elementi si troveranno dunque incolonnati in modo tale da far parte di un gruppo di elementi i quali possiedono tutti uno stesso numero di elettroni sul livello energetico più superficiale. Naturalmente il livello energetico sarà diverso da elemento a elemento.
Dunque le caratteristiche simili degli elementi che appartengono ad uno stesso gruppo chimico dipendono essenzialmente dal numero di elettroni presenti sul livello energetico più superficiale, indipendentemente dal fatto che questo sia il primo, il secondo o l'ultimo.
Gli elementi del I gruppo A hanno tutti 1 elettrone superficiale
Gli elementi del II gruppo A hanno tutti 2 elettroni superficiali
Gli elementi del III gruppo A hanno tutti 3 elettroni superficiali
E così via fino agli elementi del gruppo 0 (zero) che, avendo 8 elettroni superficiali, sono tutti stabili (gas nobili)
Come abbiamo già detto, gli atomi reagiscono tra loro utilizzando gli elettroni più superficiali, mentre gli elettroni interni non partecipano in genere alle reazioni chimiche. Inoltre gli elementi che, come il Neon, possiedono 8 elettroni superficiali (1 orbitale s e 3 orbitali p saturi) risultano particolarmente stabili, inerti, nel senso che hanno pochissima tendenza a reagire con altri elementi chimici.
Gli altri elementi che possiedono configurazioni elettroniche simili a quella dei gas nobili tendono a perdere o ad acquistare elettroni per acquisire tale configurazione particolarmente stabile. Vedremo che molte reazioni chimiche possono essere spiegate proprio in virtù della tendenza di molti elementi ad acquisire la configurazione ad 8 elettroni superficiali dei gas nobili (regola dell'ottetto).
 |
| Appunti su: livello di energia, calcolo del livello energetico di un elettrone, https:wwwappuntimaniacomscientifichechimicalivelli-energetici-ed-orbitali94php, |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |