 |
|
| Appunti superiori |
|
 |
|
| Appunti superiori |
|
| Visite: 2860 | Gradito: |
Leggi anche appunti:Drosophila melanogasterDROSOPHILA MELANOGASTER Che cos'è Drosophila La gravidanzaErroneamente oggigiorno nel linguaggio comune , quando si parla di aborto, si intende MalattiaMalattia 1 INTRODUZIONE Condizione in cui la salute |
 |
 |
L embriogenesi zigotica nelle dicotiledoni: fasi della differenziazione cellulare e principali geni coinvolti
Fecondazione e sviluppo dell'embrione
Nelle piante, il termine " embriogenesi" stabilisce l'intervallo di tempo che intercorre tra la fertilizzazione dell'ovulo e la dormienza del seme. Le fasi principali dell'embriogenesi mirano principalmente a stabilire:
un piano basale del corpo: le componenti radiali producono tre sistemi di tessuti, mentre quelle assiali stabiliscon o gli assi apicali basali (apice radice);
una separazione dei tessuti meristematici per l'elaborazione post- embrionale delle strutture delle plantule (foglie, radici, fiori ecc.. ;
un'accessibile riserva di nutrienti per la germinazione dell'embrione prima che diventi autotrofo.
Nelle Angiosperme la fecondazione avviene con l'unione dei due nuclei del gametofito maschile rispettivamente con l'oosfera e con il nucleo secondario dell'endosperma (Cappelletti, ; Ray et al., ; Gerola, . Da questa doppia fertilizzazione si originano contemporaneamente un endosperma triploide n , con funzione essenzialmente trofica, e lo zigote diploide (2n). La fertilizzazione comporta, di norma la trasformazione dell'ovulo in seme e dell'ovario in frutto.
Lo zigot e diploide, destinato a diventare embrione maturo, andrà incontro ad una serie di divisioni controllate seguite da tre fasi principali: post fertilizzazione, transizione dallo stadio globulare a quello a cuore ed espansione degli organi fino alla maturazione (Goldberg et al., ; Purves et al., ; Srivastava, ; Lo Schiavo,
Nella fase di post fertilizzazione lo zigote va incontro ad un primo allungamento mostrando una distribuzione asimmetrica del materiale cellulare: mentre nella regione superiore della cellula si localizza il nucleo e la maggior parte del citoplasma, quella inferiore è occupata da un grande vacuolo; questo squilibrio viene accentuato dopo una mitosi asimmetrica che porta alla polarizzazione della struttura con la formazione di due cellule figlie: una grande cellula basale ed una apicale più ridotta (Hymann e Stearns, . La differenza spaziale delle due cellule è legata alle diverse funzioni degli organi che verranno a formarsi successivamente: dalla cellula di dimensioni più ridotte si originerà l'embrione mentre da quella più grande e vacuolata il sospensore, un cordone cellulare con funzioni trofiche per lo sviluppo embrionale che nel tempo degenererà. I differenti tessuti che si formeranno dalle prime due cellule figlie sono legati anche alla simmetria della divisioni cellulari a cui vanno incontro, infatti la piccola cellula apicale prima si dividerà due volte longitudinalmente formando 4 cellule embrionali, e poi orizzontalmente a formare otto cellule con un dominio centrale ed apicale. La grande cellula figlia basale dello zigote andrà incontro ad una serie di divisioni trasversali originando il sospensore, organizzato in sette nove cellule che schiacciano l'embrione nel lume del seme che si sta sviluppando, mentre le cellule superiori formano l'ipofisi e contribuiscono alla formazione del meristema radicale (Haecker et al., 2004 ). L'embrione è indirizzato dalle ulteriori divisioni mitotiche, verso cambiamenti morfologici che lo portano ad abbandonare la prima forma sf erica per assumure nel tempo una simmetria bilaterale lungo l'asse apicale basale stadio a cuore e stadio a torpedine) fino alla formazione dei cotiledoni stadio cotiledonare) senza però andare incontro ad eventi di migrazione cellulare, essenziali invece nell'embriologia animale. In seguito si instaura una fase di maturazione che porta all'accumulo di proteine e di lipidi di riserva, alla disidratazione ed infine alla dormienza Bewley et al., . Questo processo di rallentamento metabolico e di riduz ione della trascrizione genica evita la precoce germinazione dell'embrione. A maturità l'embrione presenta una zona radicale inferiore, una centrale che darà l'ipocotile ed una terminale caratterizzata dai cotiledoni. All'accrescimento dell'embrione di norma si accompagna il progressivo esaurimento dell'endosperma e la digestione degli strati nocellari.
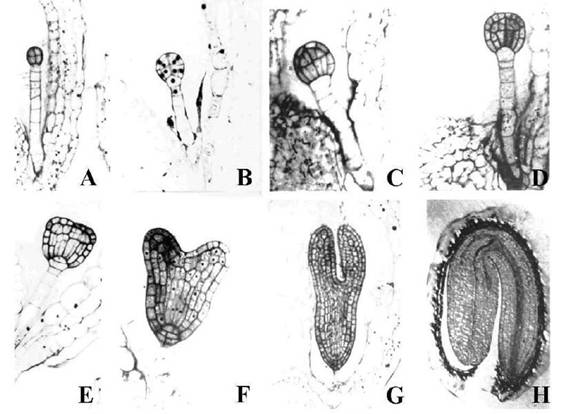
Figura : Stadi dell'embriogenesi di Arabidopsis thaliana.
A ) Stadio ottamero. Le cellule dello stadio superiore ed inferiore e le derivanti delle cellule del so spensore (cellule dell'ipofisi) formeranno porzioni specifiche della futura plantula. B) Stadio dermatogeno. Una divisione tangenziale di ognuna delle otto cellule dell'ottamero formerà le cellule interne e d epidermiche (protoderma . (C) Precoce stadio globulare . Le divisioni delle cellule centrali sono orientate lungo l'asse apicale basale, dando all'embrione un aspetto morfologicamente riconoscibile. (D) Stadio procambiale: differenti piani di divisioni cellulari hanno generato sottili cellule procambiali. In questo stadio le cellule rimangono isodiametriche. E) Stadio triangolare, si riconosco i principali elementi polarizzati: i primordi de i cotiledoni e il cilindro radiale formato da epidermide , tessuti basali e vascolari. Inoltre le divi sioni distinguono le cellule dell'ipofisi dalle cellule del sospensore. F) Stadio a cuore. Sviluppo dei cotiledoni. Divisioni delle cellule dell'ipofisi hanno generato tre st ra ti; il centro di quiescenza de l meristema radicale comincia ad emergere dallo strato superiore. G) Stadio a torpedo ; espansione di cotiledoni, ipocotile e successiva elaborazione del pattern" radicale. E' visibile la differenziazione vascolare nei cotiledoni. (H) Stadio cotiledonare. Nei cotiledoni si distingue il mesofillo a palizzata formato da cellule allungate. Nell'ipocotile si nota il cilindro vascolare formato da una singola epidermide, i due st rati corticali, l' endoderma e il periciclo. Modificato da Przemeck et al.,
2 Embriogenesi zigotica in girasole: alcune peculiarità
Per quanto concerne gli eventi di post fertilizzazione in Helianthus annuus , possiamo ricordare quanto osservato da Newcomb nel . In stadi molto precoci, la degenerazione di una sinergide segnala l'inizio dello sviluppo dell'embrione e dell'endosperma. Al contrario, l'altra sinergide è persistente fino a quando l'embrione ha raggiunto lo stadio globulare. Il nucleo dell'endosperma primario entra in divisione prima dello zigote formando una struttura cenocitica. Quando sono presenti circa otto nuclei (stadio globulare dell'embrione) le pareti si differenziano e l'endosperma appare cellularizzato all'estremità del micropilo. Allo stadio pro embrionale, il sospensore consiste di una grande cellula basale e nel complesso la sua degenerazione ha inizio nello stadio a cuore. L'indagine istologica ha chiarito che, a partire dallo stadio a cuore, una zona adiacente all'embrione appare vuota in seguito alla digestione dell'endosperma. Sulla base di tale osservazione l'autore ritiene che dopo questo stadio di sviluppo l'embrione di girasole è probabilmente indipendente dalla presenza dell'endosperma. Più recentemente, Yan e collaboratori (1991) hanno individuato una interessante peculiarità del girasole: questa specie è, al momento, l'unica a presentare uno zigote che inizia a dividersi ancora prima di essere completamente avvolto dalla parete. Per quanto concerne gli stadi avanzati dell'embriogenesi possiamo infine ricordare che, a differenza di quanto accade in specie come Capsella bursa pastoris, l'asse apicale basale non assume la tipica curvatura a U capovolto Bracegirdle e Miles, 1971; Seiler, . Inoltre, l'embrione maturo a livello dei cotiledoni è ricco in sostanze nutritive di riserve sotto forma di triacilgliceroli e tre diverse classi di proteine: eliantinine, albumine ed oleosine (Mazhar et al., ).
Principali geni coinvolti nell'embriogenesi
La regolazione dell'embriogenesi zigotica nelle piante è un fenomeno molto complesso che coinvolge numerose interazioni tra geni, prodotti genici ed ormoni, a formare una fitta rete di segnali che portano non solo allo sviluppo dell'embrione, ma anche alla costituzione dei meristemi, dei cotiledoni e ai tutti quei meccanismi di resistenza che proteggeranno l'embrione dall'ambiente esterno durante le fasi della germinazione. Occorre inoltre non sottovalutare il ruolo che meccanismi di regolazione epigenetici possono svolgere nell'embriogenesi. Negli ultimi anni è divenuto, infatti, sempre più evidente che la struttura della cromatina è fondamentale nel regolare la trascrizione dei geni e sono stati identificati fattori di rimodellamento della cromatina, importanti ai fini degli eventi di sviluppo Hsieh e Fisher, ; Reyes, , tra cui tutte le modificazioni post trascrizionali degli istoni, Loidl, 2004 . Altrettanto importante in questo codice epigenetico che agisce a monte della funzione della cromatina è il processo di metilazione del DNA.
Importanza del ruolo materno nel processo embriogenetico.
Molti studi hanno evidenziato l'importanza dell'imprinting o effetto materno nei geni coinvolti nell'embriogenesi Laux et alt., . Ad esempio, mutanti caratterizzati dalla deficienza del gene DICER-LIKE1 (DCL1) non sono capaci di sviluppare embrioni zigotici vitali Golden et al t , . Questo gene ha sede nucleare e codifica per piccole molecole di RNA con un ruolo di silenziamento genico. Si ritiene che queste molecole, prodotte nei tessuti materni, siano implicate direttamente o indirettamente nello sviluppo embrionale. E' stato inoltre accertato che il gene MEDEA (MEA), il quale codifica per una proteina di tipo "polycomb", ha un ruolo essenziale per una normale embriogenesi soltanto quando è trasmesso per via femminile. Si ritiene che il ruolo di questo gene sia la repressione della trascrizione di geni di tipo "MADS BOX" Kohler et al., ).
Stadi molto precoci dell'embriogenesi.
Uno dei primissimi segnali molecolari è stato ritrovato nella cellula uovo e nello zigote come mRNA codificante due fattori di trascrizione della famiglia WUSCHEL related homeobox2 (WOX ) e WOX8; il primo determina il destino del dominio apicale mentre il secondo svolge un ruolo specifico nel controllo dello sviluppo della parte basale dell'embrione Haecker et al., 4 ); la divisione asimmetrica dello zigote sembra servire anche alla separazione spaziale dei relativi mRNA. Nelle successive fasi di sviluppo i geni WOX2 e WOX8 ricopriranno altri ruoli fondamentali, come il mantenimento della funzionalità del meristema . Alcuni geni espressi in embrioni zigotici in stadi molto precoci ne influenzano lo sviluppo tramite la riorganizzazione di strutture exra embrionali. Ad esempio il gene YODA (YDA), codificante per proteine PKKK attivanti le divisioni cellulari, è in grado di regolare l'identità del sospensore: nei mutanti yda le cellule del sospensore vanno incontro ad un destino embrionale si dividono longitudinalmente e vengono integrate nell'embrione invece di formare il sospensore.
Formazione dell'asse apicale-basale.
Un aspetto essenziale della regolazione genica dell'embriogenesi zigotica è il controllo che alcuni geni hanno nello specificare la formazione dell'asse apicale-basale Leyser e Day, . I geni PINFORMED PIN) sono espressi in modo asimmetrico nelle cellule figlie dello zigote e codificano per proteine essenziali nel meccanismo biochimico di trasporto polare dell'auxina a livello cellulare Friml et al., . L'mRNA per PIN7 si localizza soltanto nella cellula basale derivata dalla prima divisione dello zigote e si ritiene che abbia il compito di favorire il movimento auxinico verso la cellula apicale.
Il gene PINOID (PID) codifica una Ser Thr protein chinasi che regola la localizzazione di un altro gene PINFORMED, PIN . La sovraespressione di PID causa uno spostamento della localizzazione di PIN1 verso l'apice portando alla perdita del gradiente auxinico e difetti nell'embriogenesi (sviluppo di embrioni altamente malformati).
La localizzazione polare di PIN1 in un lato della cellula è stabilito dal trasporto intracellulare vescicolare dovuto all'attività di un altro gene, GNOM (GN), e predice la direzionalità del flusso di auxine. Mutazioni nel gene GN comportano una errata localizzazione di PIN1 e ciò provoca negli embrioni la perdita della funzionalità legata alla simmetria apicale basale.
Il gene GNOM, è anche responsabile dell'espansione cellulare unidirezionale, in grado di determinare una divisione simmetrica dello zigote: i mutanti difettivi gnom formano uno zigote espanso ma non allungato questo porta ad un eccessivo ingrossamento della cellula apicale a spese della cellula basale che andrà incontro a divisioni con diversi gradi di inclinazione rispetto al piano di divisione, con conseguente sviluppo di plantule mutanti caratterizzate da una estrema variabilità fenotipica (Howell, ).
Il gene W OX2 è attivo oltre che nelle prima divisione dello zigote, anche in altri fasi dello sviluppo embrionale, è infatti espresso in quattro cellule sub epidermiche di embrioni globulari allo stadio di 6 cellule Mayer et alt , 1998 . Entrando in mit osi questo piccolo gruppo di cellule garantisce un dominio di espressione di WUS necessario per l'attività, nell'embrione maturo, sia di CLAVATA3 CLV , sia di SHOOTMERISTEMLESS STM , un gene KNOX di classe I. I tre geni sono intimamente correlati nel ma ntenere perfettamente funzionale il meristema del germoglio per l'intera vita della pianta Leyser e Day, 200 ). Il delicato equilibrio tra il pool delle cellule meristematiche e le cellule in differenziazione deve essere strettamente controllato per permettere l'emissione di nuovi organi laterali durante il corso della vita della pianta. Nel meristema apicale questo equilibrio è mantenuto attraverso l'interazione, a feed back negativo, tra le attività antagoniste della famiglia genica CLAVATA e WUS. Il gene WUS ha un ruolo importante nel promuovere l'aumento del numero di cellule del meristema Laux et alt., 1996, Mayer et alt , , mentre il pathway controllato dai fattori CLAVATA ne riduce la proliferazione Clark et alt., 1993, 1995, 1996 . Questo controllo di tipo feedback consente al meristema di mantenere un equilibrio tra la crescita numerica delle cellule e la perdita delle cellule che si trovano ad occupare le regioni periferiche, dove prende il via la formazione degli organi laterali Fletcher e Mayerowitz, 2000 . La perdita delle funziona nei geni CLAVATA porta alla formazione di un grande meristema apicale e ad un incremento del numero degli organi fiorali; ciò indica il suo ruolo nel mantenere le dimensioni del meristema. Mutazioni di WUS, possono invece condurre al mancato sviluppo del meristema caulinare. CLV1 codifica per una chinasi ricca in leucina che interagisce con le proteine ricche in leucina CLV2. WUS codifica per un fattore di trascrizione che viene espresso in un piccolo gruppo di cellule presenti nella calaza, conosciute come il centro di organizzazione. WUS induce l'identità nelle cellule poste al di sopra della calaza, le quali sono caratterizzate dall'esprimere CLV3, una piccola proteina di secrezione in grado di interagire con il complesso CLV CLV2, che limita l'espressione di WUS al centro di organizzazione. Questo feedback negativo mantiene lo stato di equilibrio e di conseguenza la giusta dimensione del meristema apicale e un apporto costante di cellule.
Implicazioni ormonali.
L'auxina è un ormone che gioca anche un importante ruolo nella formazione dei diversi pattern embrionali. Vi sono infatti numerose mutazioni, legate a geni che controllano il trasporto e/o la risposta all'ormone in grado di interferire a vari gradi con la formazione dell'asse embrionale. Per esempio, per il normale sviluppo delle radici è richiesta una specifica risposta dell'auxina nell'embrione, mediata dalle funzioni dei geni MONOPTEROS MP) e BODENLOS BDL), successivamente segnalato alle cellule dell'ipofisi. Una risposta errata al trasporto auxinico determina alterazioni nell'attività mitogena e nei piani di divisione cellulari per cui i mutanti tendono ad avere una scorretta iniziazione del meristema radicale, una deficienza del sistema vascolare e un alterato sviluppo dei cotiledoni. Mutazioni in BDL e nel gene AUXIN RESISTANT6 (AXR6) sono associate con la difettiva risposta all'auxina esogena, mentre MP codifica per un regolatore trascrizionale della famiglia "Auxin Response Factor" (ARF ).(Hamann et al.
Cambiament i di simmetria
Nel passaggio dallo stadio globulare a quello di cuore, la simmetria radiale dell'embrione è sostituita dalla simmetria bilaterale e a livello molecolare diviene fondamentale l'espressione dei geni come CUP SHAPED COTYLEDON1 CUC ), CUC2 e CUC3 che hanno lo scopo di reprimere le divisioni mitotiche nella zona centrale e, al contempo, di consentire la separazione dei due primordi cotiledonari. Aida et al., E' interessante sottolineare che l'area precocemente interessata dall'espressione di CUC1 e CUC2 è una sottile banda di cellule che divide la porzione apicale dell'embrione in un dominio mediano e due domini laterali, ove si verificherà la differenziazione dei cotiledoni Laux et al., 4 ). Le caratteristiche istologiche di espressione dei geni CUC e la loro funzione dipende comunque dai geni MONOPTEROS MP) e PINFORMED1 PIN , implicati rispettivamente nella risposta cellulare all'auxina e nel trasporto dell'ormone Aida et al., 2002).
Determinazione di un dominio basale dell'embrione
Allo stadio globulare, l'ipofisi subisce una divisione cellulare asimmetrica che determina la formazione di una cellula superiore di aspetto lenticolare ed una cellula più basale. La prima cellula è destinata a formare il centro di quiescenza del futuro apice meristematico radicale mentre la seconda produrrà le cellule della columella. A livello molecolare è stato accertato che l'espressione dei geni SCARECROW SCR) e WOX5 sono i marcatori della prima fondamentale divisione asimmetrica dell'ipofisi Haecker et al., . Nel mutante hobbit hbt) l'ipofisi si divide in modo abnorme e questo si riflette in un difettivo sviluppo dell'apice meristematico radicale Leyser e Day, . Il ruolo dell'auxina è importante anche per la localizzazione spaziale dell'apice radicale: in particolare, l'esatto posizionamento sembra dipendere dal punto di massimo accumulo di auxina. Nel mutante monopteros mp) il mancato sviluppo dell'apice radicale dipende proprio da un deficiente flusso di aux ina secondo l'asse apicale-basale Howell, 8
Fasi tardive dell'embriogenesi
Nelle fasi tardive dell'embriogenesi si attiva un complesso programma di maturazione che deve preparare l'embrione alla dormienza e poi allo sviluppo post- embrionale Bewley et al., ).
In quest'ultimo, l'ormone acido abscissico (ABA) ha un ruolo essenziale ed, infatti, i genotipi che non lo sintetizzano o che risultano insensibili a questa molecola non completano la maturazione e sviluppano embrioni non dormienti.
Sulla base dell'analisi dei fenotipi di mutanti di Arabidopsis thaliana si può ritenere che tre geni siano particolarmente importanti nel processo della maturazione: ABA - INSENSITIVE3 ABI ), FUSCA3 FUS ) e LEAFY COTYLEDON1 LEC ) (Wobus e Weber, 1999; Holdsworth et al., 1999). Questi geni non sono molecolarmente correlati e la loro espressione è importante soprattutto dopo lo stadio a cuore.
Il gene LEC1 codifica per la subunità HAP3 del fattore di trascrizione legante il sito CCAAT la cui attività risulta fondamentale sia nella fase di morfogenesi che di maturazione dell'embrione. Mutanti privi dell'attività lec1 hanno un'anormale morfologia, come lo sviluppo di tricomi sui cotiledoni, scarsa tolleranza all'essiccamento, accumulo ridotto di proteine di riserva e assenza di dormienza West et al., . L'espressione ectopica di LEC1 in piante transgeniche induc e lo sviluppo da cellule vegetative di strutture simili ad embrioni somatici Lotan et al., . Inoltre, l'analisi dell'espressione di LEC1 e omologhi di LEC1 in Arabidopsis, mais (Zea mays ) e carota Daucus carota) suggeriscono un ruolo fondamentali di questi fattori di trascrizione sia nell'embriogenesi zigotica che somatica. Ciò non è del tutto sorprendente se si considera che lo sviluppo coordinato degli embrioni somatici "in vitro", è probabilmente controllato da una gerarchia di regolazione genica analoga a quella coinvolta nello sviluppo "in vivo" degli embrioni zigotici. Il fenotipo dei mutanti fus3 è praticamente indistinguibile da quello dei mutanti lec , sebbene contrariamente ai mutanti lec1 embrioni fus3 manifestano un incremento dell'accumulo delle proteine di riserva. Analogamente ai mutanti lec , embrioni lec2 producono tricomi sui cotiledoni e mostrano una morfologia anormale del sospensore. L espressione ectopica di LEC2 induce la formazione di strutture simili ad embrioni somatici e altre strutture simili ad organ i (foglie, cotiledoni e apici meristematici) e conferisc e spesso caratteristiche embrionali alle plantule (accumulo di sostanze grasse e proteine nelle foglie .
Per quanto concerne il mutante abi3, caratterizzato da una insensibilità all'acido abscissico, gli embrioni risultano difettivi nella sintesi di specifici mRNA legati ai processi di maturazione e disidratazione West et al., ; Bewley et al., 3 ).
I geni FUS3 e LEC2 codificano una proteina con un dominio B3 conservato nei fattori di trascrizione tipo AB13. Le proteine FUS3 e LEC2 legano direttamente il motivo RY e regolano l'espressione di alcuni geni fondamentali per l embriogenesi. Sebbene l'espressione di FUS3 sia richiesta in embrioni somatici di Arabidopsis, le funzioni svolte da FUS3 durante l'embriogensi somatica non è pienamente chiarita. I geni ABA - INSENSITIVE3 ABI3 ) di Arabidopsis e il suo ortologo VIVIPAROUS1 VP ) di mais sono coinvolti nelle ultime fasi di maturazione del seme: accumulo delle sostanze di riserva, disseccamento ed entrata in dormienza. I semi dei mutanti abi3 e vp1 sono infatti insensibili all'ABA, vanno incontro a fenomeni di vivipar ia e non esibiscono né dormienza dei semi, né tolleranza alla disidratazione, mentre accumulano poche riserve proteiche.
La sintesi proteica ABA dipendente è fondamentale per l'acquisizione della tollerenza alla disidratazione, infatti, estremamente importante sembra essere la funzione protettiva che le proteine LEA svolgono a carico dei costituenti di parete in condizioni fortemente disidratate quali quelle di un seme maturo. Le proteine codificate dai geni LEA hanno la caratteristica comune di avere elementi di regolazione con sequenza centrale "G box" (CACGTG), direttamente controllati dall'ABA (Bewley et al., 2003). La bassa espressione di alcuni geni LEA in abi3 e vp1, suggerisce che ABI3/VP1 potrebbero essere importanti fattori del controllo dell'espressione di questi geni. Infatti, l'espressione di ABI3/VP1 , osservata generalmente in uno stadio molto precoce dell'embriogenesi zigotica si protrae fino alle fasi più tardive dell'embriogenesi dove interagiscono con i geni LEA.
Ci sono evidenze sperimentali di una complessa interazione fra i geni LEC1, LEC2, FUS3 and ABI3 che si instaura durante fasi diverse dello sviluppo embrionale (Parcy et al. ; Gazzarini et al., ; Kagaya et al. ; Santos Mendoza et al. ; To et al. 2006). A monte dei geni LEC, PICKLE (PKL), fattore coinvolto nel rimodellamento della cromatina è indispensabile per la repressione di questi geni in domini extra embrionali Ogas et al. 1999; Dean Rider et al. 2003 . La complessa rete di controllo genico che caratterizza questa fase dello sviluppo delle fanerogame è ulteriormente testimoniata dalla dimostrazione che membri della famiglia VP1/ABI3 LIKE VAL ) codificante fattori di trascrizione caratterizzati da un dominio conservato B3 e filogeneticamente correlati con la famiglia ABI3 FUS3/LEC2, funzionano come repressori globali di LEC B3 nei semi in germinazione Suzuki et al. 7 ).
 |
| Appunti su: embriogenesi, |
|