 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1578 | Gradito: |
Leggi anche appunti:Il modello atomico di rhuterfordIL MODELLO ATOMICO DI RHUTERFORD Rhuterford ipotizzò che la massa e la carica Dobbiamo andare tutti dall'oculista: il mondo ci inganna! TesinaDobbiamo andare tutti dall'oculista: il mondo ci inganna! Introduzione Ebbene Attivita' di visualizzazione vettoriale - rasterATTIVITA' DI VISUALIZZAZIONE VETTORIALE - RASTER Vettoriale: 2 DAC, prestazioni |
 |
 |
LE LEGGI DEI GAS E IL SIGNIDICATO DELLA TEMPERATURA
Per poter descrivere le proprietà dei gas bisogna fornire 3 valori di grandezze fondamentali:
pressione P
temperatura T
volume V
Per capire che relazione esiste tra loro dobbiamo studiare come si comporta il gas quando teniamo fissa una di queste grandezze e lasciamo variare il valore di un'altra.
Esistono tre diverse leggi, scoperte nel corso del 1650-1700, che espongono appunto quello detto sopra:
LEGGE DI CHARLES
Al variare della temperatura il volume del gas aumenta; ed esattamente questo aumenta di 1/273 del volume iniziale per ogni °C. Questo vale per tutti i tipi di gas.
|
|
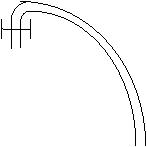
Un gas è contenuto in un recipiente chiuso in alto da un pistone che può scorrere su e giù senza attrito. La pressione a cui il gas è sottoposto è dovuta al peso del pistone + quello dei pesetti + la pressione atmosferica. Il recipiente è immerso in un bagno d'acqua , in modo che il gas sia in equilibrio termico con l'acqua e che quindi abbia la sua stessa temperatura.
LEGGE DI BOYLE - MARIOTTE
La temperatura è costante (si ha una trasformazione isoterma).
![]()
![]()
![]()
![]() Aggiungendo
altra aria e quindi altra
Aggiungendo
altra aria e quindi altra
pressione il palloncino si comprime
visibilmente, mentre la bottiglia si dilata
impercettibilmente, fino a che scoppierà

|
Se si aumenta la pressione del gas (aggiungendo pesetti sopra il pistone), il volume che esso occupa diminuisce. Il recipiente è immerso in una grossa bacinella d'acqua che serve per mantenere stabile la temperatura del gas.
Misurando pressione e volume si scopre che il volume è inversamente proporzionale alla pressione. Cioè vuol dire che il loro prodotto dà una costante:
P V = costante
Questa legge si può rappresentare in un diagramma:
|
|
LE DUE LEGGI DI GAY-LUSSAC
I gas si possono scaldare in due differenti modi:
facendo variare il volume e mantenendo la pressione costante
facendo variare la pressione e mantenendo costante il volume
Fissiamo ora la pressione.
|
|
A pressione costante
(ottenuta lasciando invariato
il numero dei pesetti sopra
il pistone) se si aumenta la
temperatura dei gas, il suo
volume cresce
Vo = volume a o°C V1 = volume a 1°C V2 = volume a 2°C V3 = volume a 3°C
V1 = Vo + 1/273 Vo = Vo (1+1/273)
V2 = V1 + 1/273 Vo = Vo + 1/273 Vo + 1/273 Vo = Vo + 2/273 = Vo (1 + 2/173)
V3 = V2 + 3/273 Vo = Vo + 1/273 Vo + 1/273 Vo + 1/273 Vo = Vo + 3/273 = Vo (1 + 3/273)
Vt = Vo (1 + t/273)
legge lineare e isobara
Per tutti i gas il coefficiente di dilatazione lineare è lo stesso
Questa legge può essere rappresentata in un diagramma
|
|
la linea è una retta; ciò fa
notare la relazione di
proporzionalità diretta tra
la variazione di volume e la variazione di
temperatura
Fissiamo ora il volume
|
|
Per mantenere costante il
volume occupato dal gas è
necessario aumentare la
pressione a cui è sottoposto
(aggiungendo dei pesetti
sopra il pistone)
Pt = Po (1 + t/273)
legge lineare e isocora
Questa legge può essere rappresentata da un diagramma
|
|
La linea è retta; ciò
visualizza la relazione di
proporzionalità diretta
tra la variazione di
pressione e di
temperatura
LA TEMPERATURA ASSOLUTA
Le leggi di Guy-Lussac:
![]()
![]() descrivono in modo
corretto il comportamento di tutti i
gas in diverse condizioni di temperatura, pressione e volume
descrivono in modo
corretto il comportamento di tutti i
gas in diverse condizioni di temperatura, pressione e volume
non sono valide quando i gas sono:
troppo densi
![]()
![]() vicini al punto in
cui liquefanno
vicini al punto in
cui liquefanno
![]()
questa proprietà dei gas, che a temperatura variabile si comportano tutti allo stesso modo, è sfruttata nei termometri a gas. Questi possono essere:
a pressione costante
a volume costante
Dalle leggi di Gay-Lussac è possibile definire una nuova scala di temperatura, la temperatura assoluta.
COME ABBIAMO FATTO A RAGGIUNGERLA?
Prendiamo in esame il grafico della I legge di Gay-Lussac
Se prolunghiamo la retta verso sinistra, essa arriva a toccare l'asse orizzontale delle temperature
Notiamo che in questo punto il volume è uguale a zero
![]() V
V
P = costante
![]()
![]() Pb B
Pb B
![]()
![]() Pa A
Pa A
![]()
![]() 0 Ta Tb T
0 Ta Tb T
Imponendo questa condizione nella I legge di Gay-Lussac, otteniamo:
0 = Vo (1 + t/273)
273 (-1) = t/273 273
t = -273°C
Questa informazione ci serve per definire una nuova temperatura T, che chiamiamo temperatura assoluta. -273°C = zero assoluto.
L'unità di misura della temperatura assoluta è il kelvin (K).
|
|
K = °C + 273
Espresse nella nuova scala le due leggi di Gay-Lussac assumono una forma più semplice. Infatti:
Vt = Vo (1 + t/273)
sostituendo al posto della t la sua espressione in funzione di T, diventa:
Vt = Vo t/273
IL SIGNIFICATO DELLA TEMPERATURA ASSOLUTA
Un gas è composto da un numero grandissimo di molecole che si muovono incessantemente in tutte le direzioni.
Questo movimento (moto di agitazione termica) porta le molecole ad urtare:
le une contro le altre
contro le pareti del recipiente
causa della pressione che il gas esercita sulle pareti del recipiente
le molecole seguono le leggi della Meccanica
è possibile mettere in relazione la pressione con le grandezze che caratterizzano il moto di ciascuna di esse
risulta che la pressione dei gas è direttamente proporzionale all'energia cinetica che ha in media una molecola. PERCHE'?
l'energia cinetica dipende dalla massa e dalla velocità della molecola
quanto più grande è la sua quantità di moto mv, con tanto maggiore "vigore" essa colpisce le pareti del recipiente
 |
| Appunti su: |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Chimica |  |