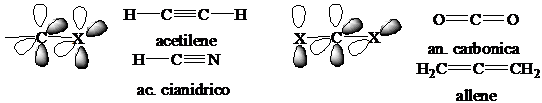Stabilizzazione di specie reattive
Potere predire la stabilità di una specie reattiva (carbocatione,
carbanione o radicale libero) è molto importante, poiché esiste un nesso
stretto tra stabilità e reattività. Minore è la
stabilità di una specie, maggiore è la sua reattività. La stabilizzazione (o
destabilizzazione) di carbocationi o carbanioni è principalmente determinata
dagli effetti elettronici I e M degli atomi (o gruppi di atomi) ad essi legati.
Vale il principio di carattere generale che una carica è tanto più
stabile quanto più è localizzata. Quindi tutti i fattori, induttivi o mesomeri,
che disperdono la carica positiva (o negativa) stabilizzano il carbocatione (o
carbanione). Viceversa, tutti i fattori, induttivi o mesomeri, che accentuano
la carica positiva (o negativa) destabilizzano il carbocatione (o
carbanione).
Carbocationi I carbocationi sono stabilizzati da
gruppi X elettron-repulsori (+I) e elettron-donatori (+M). Sono destabilizzati
da gruppi X elettron-attrattori (-I). Un radicale libero si comporta, ai fini
della stabilizzazione, come un carbocatione.
Carbanioni
I carbanioni sono stabilizzati da gruppi X elettron-accettori (-I, -M)
e destabilizzati da gruppi X elettron-repulsori (+I).
L'atomo di Carbonio può avere...
...numero
di coordinazione 4 (tetraedrica): forma
4 orbitali ibridi (sp3)1, con i quali forma 4 legami s orientati verso i vertici di
un tetraedro (angoli di 109°)
....numero di
coordinazione 3 (planare): forma 3 orbitali ibridi (sp2)1,
con i quali forma 3 legami s giacenti su un
piano (angoli di 120°); rimane un orbitale pz1 al piano dei 3
legami s, con il quale forma
un legame p
numero di
coordinazione 2 (lineare): forma 2
orbitali ibridi (sp)1, con i quali forma 2 legami s lineari (angolo di 180°).
Rimangono due orbitali, pz1 e py1, tra loro, con i
quali forma due legami p.