 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1542 | Gradito: |
Leggi anche appunti:Composti complessi e agenti complessantiComposti complessi e agenti complessanti Sali e acidi complessi appartengono Leganti inorganiciLEGANTI INORGANICI oggi parliamo dei leganti inorganici diamo una definizione Legame πLegame π Ma come possiamo interpretare il doppio o il triplo legame? Come |
 |
 |
Ricordando che i coefficienti stechiometrici di un'equazione chimica bilanciata rappresentano, in scala macroscopica, il numero di moli delle sostanze che reagiscono è allora possibile determinare i rapporti in peso, o rapporti ponderali, tra le specie chimiche.
Ricordiamo che il numero di moli (n) di una sostanza chimica è pari al suo peso in grammi (W), diviso il suo peso molare (PM)
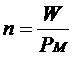
Se dunque dobbiamo calcolare a quanti grammi corrispondono 2,7 moli di anidride carbonica CO2, dopo aver calcolato il peso molare consultando la tabella periodica (PM = Peso atomico carbonio + 2 volte il Peso atomico dell'ossigeno = 12 + 2 x 16 = 44), si avrà
![]()
Esempi di calcolo ponderale
1) Data la reazione
CH4 + 2O2 CO2 + 2H2O
Calcolare quanta acqua si forma bruciando 1 Kg di metano.
Dopo aver determinato il peso molare del metano (16 g) ed il peso molare dell'acqua (18g), li moltiplichiamo per i rispettivi coefficienti stechiometrici definendo in tal modo il rapporto in peso in cui reagiscono i due composti, pari a 16/36. In altre parole per ogni 16 grammi di metano che reagiscono si formano 36 grammi di acqua.
Possiamo allora impostare la seguente proporzione
: 36 = 1000 : x
che risolta ci da il seguente risultato: x = 2250 g
2) data la reazione
FeS + 2HCl FeCl2 + H2S
calcolare quanti grammi di cloruro ferroso si formano facendo reagire 100 g di solfuro ferroso con 80 g di acido cloridrico. Calcolare quale dei due reagenti non si consuma completamente e quanto ne rimane alla fine della reazione.
Il peso molare del solfuro ferroso FeS è 87,85 g, dell'acido cloridrico HCl 36,45 g ( 2 moli peseranno allora 2 x 36,45 = 72,9 g) , del cloruro ferroso FeCl2 126,75 g
Verifichiamo allora se 100 g di FeS reagiscono effettivamente con 80 g di HCl, impostando la seguente proporzione
87,85 : 72.9 = 100 : x
da cui x = 82,98 g di acido cloridrico
Ciò significa che 100 grammi di FeS reagiscono con 82,98 g di HCl. Ma nel sistema sono presenti solo 80 g di HCl. Ne deduciamo che non tutti i 100 g di FeS sono in grado di reagire, mentre l'acido cloridrico reagirà completamente. L'acido cloridrico rappresenta la specie chimica limitante.
Vediamo allora quanti grammi di FeS reagiscono con 80 g di HCl, impostando la seguente proporzione
87,85 : 72,9 = y : 80
da cui y = 96,41 g di FeS
Alla fine della reazione troveremo perciò che 100 - 96,41 = 3,59 g di FeS non hanno reagito.
Per calcolare ora quanto FeCl2 si forma possiamo impostare una proporzione partendo indifferentemente dal peso di HCl (80g) o di FeS (96,41 g) che reagiscono. Le due proporzioni sono le seguenti
72,9 : 126,75 = 80 : z
87,85 : 126,75 = 96,41 : z
da cui z = 139,1 g di FeCl2.
 |
| Appunti su: |
|
| Appunti Biologia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Geografia |  |