 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2586 | Gradito: |
Leggi anche appunti:Legame dativo e promozione elettronicaLegame dativo e promozione elettronica Da quanto abbiamo fin qui visto ci Diffusione ed entropiaDiffusione ed entropia La diffusione è dunque un movimento spontaneo delle Interazione tra geniInterazione tra geni In alcuni casi un gene può interagire con altri geni |
 |
 |
L'elettrodo ad idrogeno può quindi funzionare, a seconda delle coppie redox con cui viene messo in contatto, sia come anodo che come catodo (naturalmente ciò vale anche per qualsiasi altra coppia redox, che può ridursi o ossidarsi a seconda dei casi).
Deve comunque essere chiaro che il potenziale di una certa semicella non è un potenziale assoluto, ma una differenza di potenziale con l'elettrodo normale ad idrogeno. Tali potenziali misurano la tendenza di una certa semicella a dare una reazione di riduzione rispetto all'elettrodo ad idrogeno.
Zinco vs SHE - Se ad esempio poniamo la coppia redox Zn2+/Zn (in condizioni standard [Zn2+] = 1 M) a contatto con l'elettrodo normale ad idrogeno, possiamo misurare una differenza di potenziale di ΔE° = 0.763 V.
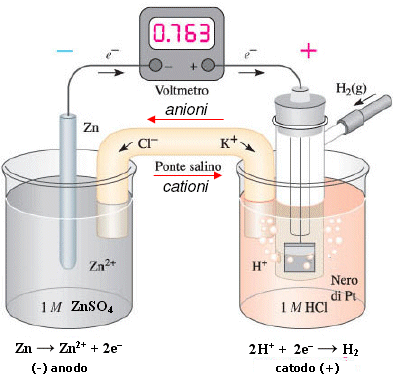
(-) Zn (s) │ Zn2+ (aq, 1 M) H+ (aq, 1 M) │Pt (H2, 1 atm) (+)
oppure
(-) Zn (s) │ Zn2+ (aq, 1 M) SHE (+)
Poiché si osserva che lo zinco si ossida cedendo elettroni agli ioni H+ che si riducono ad idrogeno gassoso (possiamo verificarlo osservando che, come conseguenza della diminuzione della concentrazione degli ioni H+, il pH della soluzione catodica aumenta), lo zinco funge da anodo mentre l'idrogeno da catodo.
Si avrà dunque
![]()
ed essendo per definizione ![]()
![]()
e quindi
![]()
Il segno negativo ci informa che rispetto all'idrogeno la reazione di riduzione non è spontanea.
Tutte le semicelle che in condizioni standard si ossidano rispetto a all'elettrodo normale ad idrogeno assumono potenziali standard di riduzione negativi. Più basso è il potenziale di riduzione di una coppia redox e maggiore è la sua tendenza ad ossidarsi
Rame vs SHE - Se invece poniamo la coppia redox Cu2+/Cu a contatto con l'elettrodo ad idrogeno, possiamo misurare una differenza di potenziale di 0,337 V.
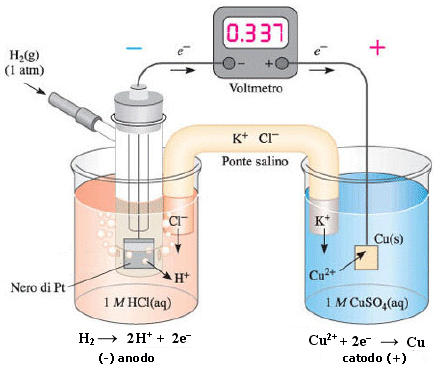
(-) Pt (H2, 1 atm) │H+ (aq, 1 M) Cu2+ (aq, 1 M) │ Cu (s) (+)
oppure
(-) SHE Cu2+ (aq, 1 M) │ Cu (s) (+)
Poiché in questo caso è l'idrogeno che si ossida cedendo elettroni al rame (possiamo verificarlo osservando che, come conseguenza dell'aumento della concentrazione degli ioni H+, il pH della soluzione anodica diminuisce), l'idrogeno funge da anodo mentre il rame da catodo.
Si avrà dunque
![]()
ed essendo per definizione ![]()
![]()
e quindi
![]()
Il segno positivo ci informa che rispetto all'idrogeno la reazione di riduzione è spontanea.
Tutte le semicelle che in condizioni standard si riducono rispetto a all'elettrodo normale ad idrogeno assumono potenziali standard di riduzione positivi. Più elevato è il potenziale di riduzione di una coppia redox e maggiore è la sua tendenza a ridursi
 |
| Appunti su: potenziali redox, potenziale di riduzione, potenziale standard idrogeno, potenziale di riduzione ponte salino ioni H, |
|
| Appunti Biologia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Geografia |  |