 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3433 | Gradito: |
Leggi anche appunti:Acidi e basi secondo LewisAcidi e basi secondo Lewis La definizione più estensiva di acido e base Il 1918 la scoperta della sintesi dell'ammoniacaIl 1918 la scoperta della sintesi dell'ammoniaca Il 1918 lo studioso tedesco Cariche formaliCariche formali Per l'attribuzione delle cariche formali si procede come segue. |
 |
 |
Da quanto abbiamo fin qui visto ci si potrebbe attendere che il numero di legami covalenti che un atomo può formare non possa mai essere superiore al numero di elettroni spaiati che deve condividere al fine di completare l'ottetto. In realtà ciò è vero nella maggior parte dei casi, ma non in tutti.
In alcuni casi gli atomi riescono infatti a formare più legami di quanti apparentemente sembra loro consentito sulla base della loro configurazione elettronica superficiale. E' necessario tener presente che ogni legame in più che si forma produce un ulteriore aumento di stabilità della molecola e dunque gli atomi tendono a massimizzare il numero di legami formati.
La formazione di legami di tipo "dativo" ed i processi di "promozione elettronica" sono stati introdotti per giustificare la formazione di ulteriori legami rispetto al numero di elettroni spaiati di un atomo.
Legame dativo
Un legame covalente si può formare a partire da un doppietto elettronico messo a disposizione da un atomo donatore (o datore) e da un orbitale vuoto messo a disposizione da un atomo accettore.
Tale legame è detto legame covalente dativo ed una volta formatosi è indistinguibile da un normale legame covalente.
Il legame dativo può essere rappresentato come una freccia che va dal doppietto solitario dell'atomo datore D all'atomo accettore A.
D:→A
Si consideri ad esempio lo Zolfo e l'Ossigeno, entrambi appartenenti al VI gruppo A, aventi configurazione superficiale s2p4, con due doppietti, due elettroni spaiati e due elettroni mancanti per raggiungere la configurazione dell'ottetto.
![]()
Sulla base delle configurazioni superficiali dei due elementi ci potremmo attendere la formazione di un composto del tipo S=O, con formazione di un legame covalente doppio a seguito della condivisione di entrambi gli elettroni spaiati di ciascun elemento. In questo modo ciascun atomo completa infatti l'ottetto.
![]()
In realtà quando lo Zolfo reagisce con l'Ossigeno genera SO2 (anidride solforosa) ed SO3 (anidride solforica), riuscendo in tal modo a legare fino ad altri due atomi di ossigeno in più rispetto a quanto previsto.
Per giustificare la formazione di questi legami si ammette dunque che lo zolfo possa utilizzare per legarsi non solo gli elettroni spaiati, ma anche i doppietti solitari. Tuttavia l'Ossigeno non ha orbitali superficiali vuoti da poter utilizzare.
Si ammette quindi che l'Ossigeno possa subire una transizione dalla configurazione più stabile, prevista dalla regola di Hund ad una configurazione, meno stabile nella quale un elettrone viene spostato da un orbitale p semisaturo, generando un orbitale vuoto, all'altro orbitale p semisaturo.
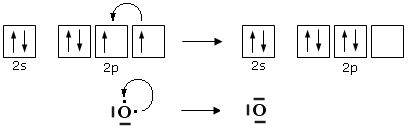
In questo modo l'ossigeno possiede ora un orbitale p vuoto che può utilizzare come accettore di un doppietto elettronico per formare un ulteriore legame chimico con lo zolfo di tipo dativo, per dare l'anidride solforosa SO2. Il passaggio dell'ossigeno ad una configurazione meno stabile richiede ovviamente energia, ma questa viene più che compensata dall'aumento di stabilità che si ottiene con la formazione di un ulteriore legame.
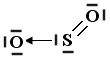
Nel caso lo Zolfo utilizzi entrambi i suoi doppietti solitari per formare due legami dativi con altrettanti atomi di ossigeno si forma l'anidride solforica SO3.
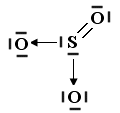
Il legame dativo ci permette di giustificare la capacità che hanno molti elementi ( in particolare gli elementi alla fine di un periodo) di formare un numero variabile di legami con l'ossigeno (valenza variabile) legandosi con esso in diverse proporzioni (legge delle proporzioni multiple di Dalton).
Il cloro, ad esempio, che possiede una configurazione superficiale s2 p5, presenta un elettrone spaiato e ben tre doppietti non condivisi disponibili per legami dativi. Si giustificano in tal modo l'esistenza di ben quattro composti ossigenati del cloro: l'anidride ipoclorosa Cl2O, l'anidride clorosa Cl2O3, l'anidride clorica Cl2O5 e l'anidride perclorica Cl2O7.
Non è necessario che un atomo liberi un orbitale per poter effettuare un legame dativo. In molti casi esistono già orbitali naturalmente liberi.
Un esempio si ha nella reazione di dissociazione ionica dell'acqua in ioni H+ e ioni OH-. In realtà in soluzione non esistono ioni H+ liberi poiché essi usano il loro orbitale 1s vuoto per legarsi, tramite legame dativo, ad uno dei due doppietti solitari dell'ossigeno di una molecola d'acqua, con formazione di ioni ossonio (o idronio) H3O+.
H2Ōı→H+ = H3O+
Una volta che lo ione ossonio si è formato, i 3 atomi di idrogeno sono perfettamente equivalenti ed i tre legami covalenti che li legano all'ossigeno risultano indistinguibili.
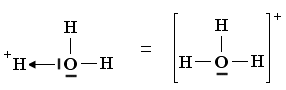
Ione ossonio
Promozione Elettronica
Come abbiamo appena visto, la formazione di legami stabilizza la molecola al punto che, in alcuni casi, un atomo può assumere configurazioni elettroniche meno stabili che tuttavia gli consentono di formare un maggior numero di legami. La promozione elettronica, ad esempio, è un processo di questo tipo, che consente ad un atomo di trasferire un elettrone da un orbitale superficiale saturo ad un orbitale superficiale vuoto. In questo modo un doppietto viene trasformato in due elettroni spaiati che, condivisi con altri atomi, possono essere utilizzati per formare due ulteriori legami chimici.
E' il caso del Carbonio che, in quasi tutti i suoi composti promuove un elettrone dall'orbitale saturo 2s ad un orbitale 2p vuoto
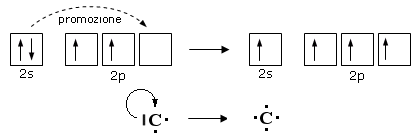
Pur passando da una configurazione elettronica superficiale più stabile ad una meno stabile, il Carbonio dispone ora di 4 elettroni spaiati (contro i due precedenti) che può condividere formando 4 legami chimici.
La promozione elettronica avviene quando la differenza di energia tra l'orbitale di partenza e quello di arrivo è piccola.
 |
| Appunti su: il legame dativo e indistinguibile da, promozione elettronica chimica, https:wwwappuntimaniacomscientifichechimicalegame-dativo-e-promozione-ele44php, |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Ingegneria tecnico |  |