 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 5082 | Gradito: |
Leggi anche appunti:GlicolisiGLICOLISI La Glicolisi ( o ciclo degli esosi in quanto si Nomenclatura tradizionale e nomenclatura sistematica (IUPAC)Nomenclatura tradizionale e nomenclatura sistematica (IUPAC) La nomenclatura Legge di Dalton o delle pressioni parzialiLegge di Dalton o delle pressioni parziali Quando due o più gas vengono |
 |
 |
Per meglio comprendere il fenomeno dell'ibridazione, è conveniente ipotizzare che per formare i legami gli elementi tendano a disaccoppiare gli elettroni, quando possibile, in orbitali liberi a contenuto energetico superiore.
Nonostante questo processo richieda una spesa di energia, esso è
termodinamicamente vantaggioso poiché consente la formazione di un numero
maggiore di legami, dando così origine ad un 'sistema' a più basso
contenuto di energia e di conseguenza più stabile (nella formazione del legame
chimico si libera infatti energia).
Per gli elementi del 2° periodo, il numero massimo di legami che un elemento può formare è quattro (regola dell'ottetto).
A partire dagli elementi del 3° periodo, la possibilità di disaccoppiare gli
elettroni è ancora più ampia poiché, a differenza degli elementi del 2°
periodo, essi 'dispongono' di orbitali d da utilizzare per
accogliere gli elettroni disaccoppiati. In questo modo, questi elementi possono
formare un numero di legami anche superiore a quattro (espansione
dell'ottetto).
Il fenomeno dell'ibridazione può essere introdotto in maniera semplice ed efficace prendendo a modello l'atomo di carbonio. Tale base di partenza ci servirà sia come introduzione ai composti della chimica organica -la chimica del carbonio-, sia per discutere l'ibridazione nelle altre molecole.
Considerando
la configurazione elettronica esterna del carbonio (2s22p2),
dovremmo aspettarci che esso fosse dicovalente, avendo solo due elettroni
spaiati negli orbitali 2p per formare legami. In realtà, salvo rarissime
eccezioni (ad esempio CO o C2), il carbonio forma sempre quattro
legami.
Se supponiamo che uno dei due elettroni 2s sia promosso (eccitazione) in un
orbitale 2p vuoto, otteniamo una configurazione elettronica esterna 2s
2p3, con quattro elettroni spaiati, tale da giustificarne la
tetracovalenza.
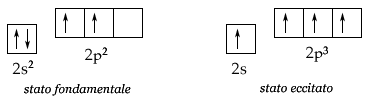
Questo processo richiede ovviamente una spesa di energia (circa 96 kcal/mole) - gli orbitali p si trovano ad un livello energetico superiore rispetto agli s -, ma è termodinamicamente vantaggioso poiché in questo modo si possono formare quattro legami, anziché due soltanto. L'energia spesa per la promozione di un elettrone è infatti ampiamente compensata dalla liberazione di energia conseguente alla formazione di due ulteriori legami (circa 200 kcal/mole nel caso di due legami C-H). Inoltre, tutto ciò consente al carbonio di raggiungere una configurazione otteziale.
Sebbene l'ipotesi dell'eccitazione dell'atomo di carbonio ne giustifichi la tetravalenza, essa non è ancora sufficiente a spiegare l'osservazione sperimentale che i quattro legami del carbonio in composti come gli alcani (gli idrocarburi saturi, di cui il metano, CH4, è il primo termine) siano tutti equivalenti.
Con la semplice promozione di un elettrone dall'orbitale 2s al 2p vuoto, ci si aspetterebbe che uno dei legami del carbonio avesse caratteristiche diverse da quelle degli altri tre. Nel caso di quattro legami con altrettanti atomi di idrogeno, tre legami C-H (quelli che coinvolgono gli elettroni 2p) dovrebbero trovarsi a 90° tra loro, mentre il quarto legame (quello che coinvolge l'elettrone 2s) si dovrebbe disporre il più lontano possibile dagli altri tre, con un'angolazione di 125° rispetto ad essi. Inoltre, anche la forma e l'energia del quarto legame dovrebbero differire da quelle degli altri.
La teoria dell'ibridazione propone un modello in grado di spiegare le osservazioni sperimentali di perfetta equivalenza dei quattro legami del carbonio negli alcani. In termini semplicistici, l'ibridazione può essere considerata come una sorta di rimescolamento dei quattro orbitali atomici - un s e tre p puri del carbonio - a formare quattro nuovi orbitali, detti ibridi sp3, tutti equivalenti fra loro, ciascuno dei quali assomma per un quarto le caratteristiche dell'orbitale s e per tre quarti quelle degli orbitali p. La forma di un orbitale ibrido sp3 è simile a quella di un orbitale p, ma le dimensioni dei due 'lobi' sono molto diverse.
|
|
|
Formazione di un orbitale ibrido sp3 |
|
Quello rappresentato in figura è il corretto contorno della densità di probabilità elettronica di un orbitale ibrido sp3 del carbonio. Spesso, quando si rappresentano gli orbitali ibridi si tende ad allungarli per metterne in evidenza la direzionalità lungo un asse. Ricordiamo che i segni + e - indicano il segno delle ψ e non cariche elettriche. |
Nel rispetto della regola che vuole che gli orbitali si dispongano nello spazio alla massima distanza l'uno dall'altro per minimizzare la repulsione elettrostatica fra le nubi elettroniche, gli orbitali ibridi sp3 si orientano secondo una geometria tetraedrica, ovvero formando fra loro angoli di 109° 28'.
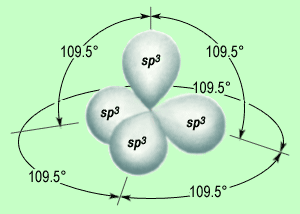
|
Ciascuno degli orbitali ibridi può formare un legame σ con un O.A. di un altro atomo, purché i due si trovino diretti lungo l'asse di legame. Nel caso della molecola del metano, il più semplice degli idrocarburi, ciascun orbitale ibrido sp3 forma un legame σ con l'orbitale 1s di un atomo di idrogeno. Nel modello a fianco è rappresentata la molecola del metano: l'atomo di carbonio, al centro, forma quattro legami con altrettanti atomi di idrogeno e ogni angolo di legane H-C-H è circa 109.5°. |
|
L'ibridazione sp3 si può incontrare anche in molecole contenenti solo tre o due legami covalenti, come l'ammoniaca (NH3) o l'acqua (H2O).
La geometria molecolare dell'ammoniaca si può interpretare adeguatamente alla luce del fenomeno dell'ibridazione, assumendo che anche l'azoto, come il carbonio, generi quattro orbitali ibridi sp3; ma in questo caso solo tre di essi formano legami σ con atomi di idrogeno, mentre il quarto resta impegnato da un doppietto elettronico solitario.
|
|
|
Geometria molecolare del metano, dell'ammoniaca e dell'acqua |
La geometria molecolare è quindi anche in questo caso tetraedrica. Il fatto che gli angoli di legame (107°) deviino leggermente dal valore dell'angolo tetraedrico ideale, è giustificato dal fatto che nella molecola di NH3 non vi può essere una perfetta equivalenza dei quattro orbitali ibridi, poiché uno si trova in una condizione diversa dagli altri, non essendo impegnato in un legame.
Le stesse argomentazioni usate per l'ammoniaca possono essere applicate alla molecola dell'acqua. I dati sperimentali indicano che l'angolo di legame H-O-H è di circa 105°, anch'esso molto prossimo al valore tetraedrico. Anche l'acqua ha quindi una geometria tetraedrica, che trova giustificazione in una ibridazione sp3 dell'ossigeno. Due orbitali sp3 restano stavolta impegnati da altrettanti doppietti solitari, mentre gli altri due formano legami σ con due atomi di idrogeno. La contrazione dell'angolo di legame, più sensibile che in NH3, si spiega considerando che in questo caso sono due i doppietti solitari in orbitali di non legame.
L'ibridazione sp3 non è l'unica possibilità del carbonio di ibridare i suoi quattro orbitali atomici; oltre a questa, ve ne sono altri due tipi: sp2 e sp.
|
Nell'ibridazione
sp2, vengono ibridati l'orbitale 2s e solo due orbitali 2p,
in modo da formare tre orbitali ibridi equivalenti, che si dispongono
su un piano con angoli di 120° l'uno dall'altro. La geometria è quindi planare-triangolare.
L'orbitale 2p che non partecipa all'ibridazione è disposto perpendicolarmente
al piano sul quale giacciono gli orbitali ibridi (vedi figura a fianco). |
|
Abbiamo già sottolineato che il legame π si può realizzare solo quando gli orbitali p coinvolti siano paralleli fra loro: solo in questa situazione, infatti, la sovrapposizione fra i due orbitali può essere massima. Ogni deviazione dalla condizione di parallelismo riduce il grado di sovrapposizione, che diventa nulla quando gli orbitali p sono ortogonali fra loro. Per questo motivo, lungo l'asse del doppio legame non si può avere libera rotazione, che è invece possibile intorno al legame semplice σ. Il doppio legame rappresenta quindi un punto di rigidità della molecola e tutto ciò ha importanti ripercussioni sulla geometria molecolare e sulle proprietà chimico-fisiche stesse dei composti contenenti doppi legami. In particolar modo, questo aspetto dovrà essere tenuto in considerazione sia nel caso dei composti organici insaturi, sia in biochimica, per quanto riguarda le caratteristiche del legame peptidico delle proteine.
Tra gli idrocarburi, il doppio legame carbonio-carbonio caratterizza la classe degli alcheni, di cui l'etene (CH2=CH2) è il primo termine della serie. Altri esempi di molecole con ibridazione sp2 sono il trifluoruro di boro, il tricloruro di alluminio, lo ione nitrito, lo ione nitrato e lo ione carbonato.
|
|
|
Geometria triangolare-planare di etene, BF3 e NO2- |
Infine, sempre riferendosi al carbonio, nel caso dell'ibridazione sp, solo l'orbitale 2s e un orbitale 2p sono ibridati, generando due orbitali ibridi equivalenti, orientati in direzioni opposte lungo una linea retta. I due rimanenti orbitali 2p puri si dispongono ortogonalmente all'asse degli ibridi sp e ortogonalmente l'uno rispetto all'altro.
|
Due atomi
di carbonio con ibridazione sp possono legarsi formando un triplo
legame. Il legame σ si forma dalla sovrapposizione di due orbitali sp
diretti lungo l'asse di legame, mentre i due legami π si formano dalla
sovrapposizione laterale di coppie di orbitali p puri paralleli, come
è mostrato nella figura a fianco. |
|
La geometria degli ibridi sp è invariabilmente lineare, con angoli di legame di 180°. L'ibridazione sp si incontra in molte altre molecole che contengono un triplo legame (N2, HCN), due doppi legami cumulati (CO2 e alleni) o due soli legami semplici, come il dicloruro di berillio (BeCl2), che tuttavia come molecola isolata esiste solo allo stato di vapore.
Esistono diversi altri tipi di ibridazione che coinvolgono anche orbitali di tipo d e che peraltro sono abbastanza frequenti nei casi in cui si supera la regola dell'ottetto; di questi tuttavia non ci occuperemo, considerate le finalità del nostro corso.
Ibridazione e geometria molecolare sono strettamente correlate fra loro.
Descriveremo ora un metodo basato su poche semplici regole pratiche, attraverso il quale è possibile riconoscere in maniera immediata il tipo di ibridazione di un atomo e la corrispondente geometria molecolare.
L'atomo a cui fare riferimento è l'elemento centrale della struttura: in
molti casi si tratta dell'elemento meno elettronegativo, tranne
ovviamente quando sia coinvolto l'idrogeno che deve necessariamente occupare
una posizione 'laterale', potendo formare un unico legame covalente.
 |
| Appunti su: orbitali ibridi angolazioni, trifluoruro di boro ibridazione, https:wwwappuntimaniacomscientifichechimicaorbitali-ibridi73php, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Geografia |  |
| Lezioni Biologia |  |