 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1585 | Gradito: |
Leggi anche appunti:AmmineAmmine Costituiscono il più importante gruppo funzionale contenente azoto Equilibrio di solubilità, idrolisi e pHEquilibrio di solubilità, idrolisi e pH Il calcolo della solubilità di un Due esempi di risonanza: il gruppo carbossilico ed il gruppo peptidicoDue esempi di risonanza: il gruppo carbossilico ed il gruppo peptidico Il |
 |
 |
Anche nel caso degli acidi deboli, come abbiamo visto per gli acidi forti, possiamo evitare di tener conto dell'equilibrio dall'acqua nel calcolo del pH solo se l'acido produce una quantità di ioni H+ sufficientemente elevata, da rendere trascurabili gli ioni H+ generati dall'acqua . In generale gli ioni H+ generati dall'acido dovrebbero almeno essere in quantità superiore od uguale a 10-6 mol/L ([H+]acido ≥ 10-6 M), in modo da poter trascurare i 10-7 mol/L generati dalla dissociazione dell'acqua.
Nel caso degli acidi forti era sufficiente che la concentrazione dell'acido fosse superiore a 10-6 mol/L. Ma nel caso di un acido debole non è possibile far riferimento solo alla sua concentrazione iniziale C poiché la quantità di ioni H+ generati dipende anche dalla sua ka.
Vediamo allora quali condizioni debbano essere soddisfatte per poter trascurare gli ioni H+ generati dall'acqua.
Consideriamo il solito acido debole generico HA. L'equilibrio di dissociazione è
HA ![]() H+ + A-
H+ + A-
e la costante di equilibrio vale
![]()
Se poniamo pari ad x il numero di mol/L di HA che si dissociano, possiamo costruire la seguente tabella delle concentrazioni iniziali e delle concentrazioni di equilibrio
|
Specie |
Concentrazioni iniziali |
Concentrazioni all'equilibrio |
|
HA |
C |
C - x |
|
H+ |
|
x |
|
A- |
|
x |
Poniamo ora, come al solito, le concentrazioni di equilibrio, espresse in funzione di x, in relazione con la ka
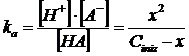
Abbiamo visto nel paragrafo precedente che, nel caso in cui ![]() ≥ 102, l'acido risulta poco
dissociato, presentando un grado di dissociazione α < 0.1.
≥ 102, l'acido risulta poco
dissociato, presentando un grado di dissociazione α < 0.1.
Questo significa che la quantità x di acido che si dissocia è piccola e trascurabile rispetto alla concentrazione iniziale C dell'acido (x << C). Possiamo allora ragionevolmente assumere che all'equilibrio la quantità (C - x) sia praticamente uguale a C
C - x ≈ C
Trascurando dunque la x nella differenza a denominatore nella equazione di equilibrio, otterremo
![]()
![]()
che ci permette di calcolare la concentrazione tramite la seguente relazione semplificata
![]()
Eseguendo il logaritmo decimale negativo di entrambi i membri si ha
pH = ½ (pka -logC)
e, per una base debole,

pOH = ½ (pkb -logC)
Osserviamo tuttavia che tale relazione fornisce risultati accettabili finchè C·ka ≥ 10-12.
Infatti, qualora il prodotto C·ka risultasse inferiore a 10-12, si otterrebbe una concentrazione di ioni H+ (o OH- per una base debole) inferiore a 10-6 e quindi non potremmo più trascurare gli ioni provenienti dalla dissociazione dell'acqua.
In generale è dunque possibile trascurare l'equilibrio dell'acqua ed usare tale metodo approssimato quando il prodotto tra la concentrazione iniziale e la costante di dissociazione dell'acido debole è superiore o uguale a 10-12 ed il rapporto tra la sua concentrazione iniziale e la sua costante di dissociazione è superiore o uguale a 102.
C·ka ![]() ≥ 102
≥ 102
Nella tabella seguente riportiamo il valore del pH calcolato per
l'intervallo di valori di C e ka
all'interno del quale è possibile usare il metodo approssimato (C·ka ≥ 10-12 e ![]() ≥ 102).
≥ 102).
In ogni casella compaiono 3 valori di pH calcolati rispettivamente
con l'equazione di terzo grado che tiene conto anche della dissociazione dell'acqua (valore esatto)
con l'equazione di secondo grado che trascura la dissociazione dell'acqua
con la relazione semplificata che trascura la x a denominatore nell'equazione di secondo grado
|
pH |
Costante di dissociazione acida - Ka |
|||||||||||
|
C mol/L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Si noti come la relazione semplificata fornisca valori migliori quando il rapporto C/ka è più elevato e quindi l'acido è meno dissociato (grado di dissociazione basso e quindi x molto piccola rispetto a C).
 |
| Appunti su: acidi e basi deboli trascuro x al denominatore, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |