 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2476 | Gradito: |
Leggi anche appunti:L'idrolisi come reazione acido-base di BrønstedL'idrolisi come reazione acido-base di Brønsted Come avremo modo di vedere Cenni sulla simmetria delle molecoleCenni sulla simmetria delle molecole Una molecola possiede simmetria se presenta Il pH: La misura dell'acidità e della basicità delle soluzioniIl pH: La misura dell'acidità e della basicità delle soluzioni Il prodotto ionico |
 |
 |
La risonanza in legami p
Nella trattazione del legame chimico secondo il modello valence bond riveste particolare importanza il concetto di indistinguibilità degli elettroni, che porta a formulare le forme in risonanza di Lewis del legame s, già viste.
Le forme in risonanza di Lewis descrivono altrettanto bene anche il legame p

La risonanza in legami p coniugati
In una molecola avente più doppi legami, i legami p possono essere isolati o coniugati. Rivestono particolare importanza legami p coniugati in catene di atomi di carbonio. Questi si possono formare quando la catena è composta da una serie ininterrotta di atomi di carbonio sp2, ciascuno avente un orbitale p contenente un elettrone spaiato.
Il sistema più semplice di legami p coniugati è costituito dall'1,3-butadiene, in cui si ha una serie ininterrotta di 4 atomi di carbonio sp2 (nelle figure che seguono viene indicata solo la struttura della catena principale; ciascun vertice è occupato da un atomo di carbonio; gli altri atomi legati al carbonio non sono indicati).
La sovrapposizione degli orbitali p 1-2 e 3-4 porta alla formazione di 2 legami p coniugati, per i quali sono possibili varie forme di risonanza. Le forme A,B,C,D sono quelle previste per due legami p semplici (non coniugati). Sono però possibili altre due forme in risonanza, E e F, che derivano dalla sovrapposizione degli orbitali 2,3.
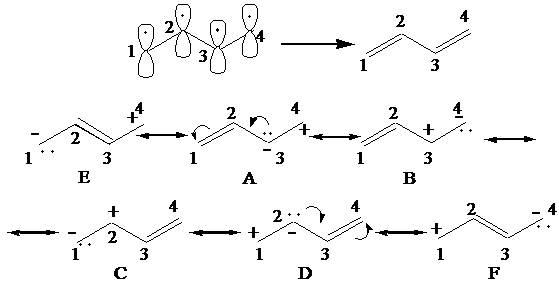

Le strutture E
e F non sarebbero possibili se i due
doppi legami fossero isolati, come nel caso del 1,4-pentadiene:
La coniugazione determina una maggiore indistinguibilità degli elettroni, che non sono più localizzati tra due atomi, ma delocalizzati su tutta la catena. Questa è espressa dal maggior numero di forme in risonanza (dette anche forme mesomere) che è possibile scrivere.
La delocalizzazione degli elettroni in un sistema p coniugato (ovvero, la maggiore indistinguibilità degli elettroni) determina una maggiore stabilità della molecola.
Questa extra-stabilità è chiamata energia di risonanza.
Corollario: maggiore il numero di strutture in risonanza
(forme mesomere), maggiore la stabilità della molecola
Nota: Le risonanza tra due forme si indica con una freccia a due punte. Lo spostamento di elettroni che si compie per passare da una forma all'altra si indica con una freccia curva. Se vengono spostati elettroni di legame, la freccia parte dalla metà del legame; se viene spostato un doppietto di non legame, parte dal doppietto. Se gli elettroni vengono spostati tra due atomi, la freccia arriva tra i due atomi; se vengono spostati su un atomo, arriva su quell'atomo. Se viene spostato un solo elettrone, si usa una freccia a mezza punta.
Berlino, 1896 - Marburg,
1980 Nel 1931 formulò la "Regola di Huckel" per determinare se molecole
cicliche sono armatiche. Nel 1937 sviluppò la teoria approssimata degli
orbiali molecolari per molecole organiche insature.
Erich
Armand Arthur Joseph Hückel

Le regole della risonanza.
1. Le strutture in risonanza sono strutture limite di una stessa molecola, quindi devono avere la stessa disposizione spaziale degli atomi.
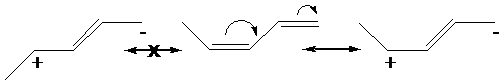
Non tutte le strutture in risonanza contribuiscono con lo stesso peso alla stabilità della molecola. Hanno peso maggiore le strutture in cui vi è minore separazione di carica e/o il maggior numero di legami.

3. Nelle strutture in cui vi è separazione di carica, il peso è tanto maggiore quanto maggiore è l'elettronegatività dell'atomo su cui si localizza la carica negativa.

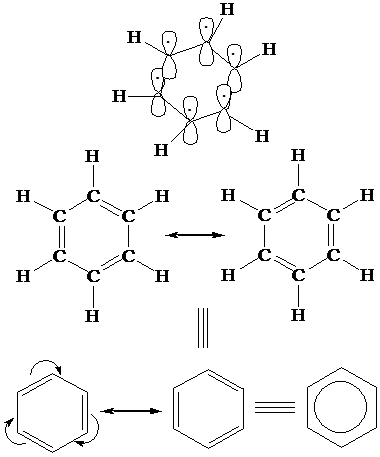
Aromaticità
Molecole che hanno un sistema ciclico di legami p coniugati mostrano una energia di risonanza particolarmente alta quando il numero di elettroni è (4n + 2) [Regola di Huckel].
Questa extra-stabilità è chiamata aromaticità.
Le molecole sono dette aromatiche.
Il capostipite dei composti aromatici è il benzene [C6H6], costituito da un ciclo a 6 termini di atomi di carbonio sp2 contenenti 6 elettroni p (4n + 2; n = 1) delocalizzati su tutta la catena ciclica.
Fattori che determinano la reattività delle molecole organiche
La reattività delle molecole organiche è governata da tre effetti principali:
Effetti elettronici, che si possono propagare attraverso legami s (effetti induttivi) o legami p (effetti mesomeri).
Effetti sterici, determinati dall'ingombro spaziale degli atomi, o gruppi di atomi; la loro importanza aumenta all'aumentare delle dimensioni e al diminuire della distanza.
Effetti di tensione angolare, osservabili nella reattività di piccoli cicli a 3 o 4 termini.
Sir Christopher Kelk Ingold
(1893 - 1970) Laureatosi
all'Imperial College di Londra nel 1921, nel 1934 pubblicò la teoria sugli
effetti elettronici nelle reazioni organiche, che divenne nota come la 'English heresy'. Solo alla fine degli anni 30 le sue
teorie vennero universalmente accettate. Con Ingold la Chimica Organica diviene
Scienza predittiva, non più empirica.

 |
| Appunti su: elettroni delocalizzati, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |