 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 7259 | Gradito: |
Leggi anche appunti:La pila di VoltaLa pila di Volta Volta occupa un posto molto importante nella storia dell'elettrochimica per Teoria di Lewis del legame covalenteTeoria di Lewis del legame covalente L'ipotesi del legame covalente come doppietto Lo stato GassosoLo stato Gassoso Il gas è uno stato fluido della materia che riempie il |
 |
 |
La nomenclatura dei composti organici
I composti organici sono molti milioni. E' evidente come sia impossibile classificarli in assenza di una nomenclatura sistematica. Esistono due sistemi ufficiali di nomenclatura, che fanno riferimento alla CAS (Chemical American Society) e alla IUPAC (International Union Pure and Apllied Chemistry). Il nome di un composto organico deve risultare come un'etichetta identificativa dalla quale sia possibile ricavare tutte le informazioni che ci permettano di risalire alla struttura. In particolare, deve contenere una radice, che identifica il numero di atomi di carbonio che costituiscono la catena, e un suffisso, che identifica il gruppo funzionale. In presenza di più gruppi funzionali si ricorre all'utilizzo di prefissi. Dal nome si deve capire anche la disposizione spaziale degli atomi (stereochimica). Accanto ai nomi ufficiali rimangono in uso, specie per le sostanze note da lungo tempo, nomi comuni (triviali)
Le norme da seguire nella nomenclatura chimico-organica sono molte e, molto spesso, complicate. Tuttavia, per idrocarburi, composti monofunzionali e semplici composti polifunzionali si possono dettare alcune regole di facile apprendimento, con le quali lo studente dovrà familiarizzare.
Nomenclatura degli idrocarburi.
In un idrocarburo lineare la radice del nome definisce il numero di atomi di carbonio (met, et, prop, but, pent, es, etc), il suffisso (ano, ene, ino) la presenza o meno di un doppio o un triplo legame [vedi Tabella 1].
In presenza di più doppi o tripli legami il suffisso ene o ino è preceduto da di tri tetra, a seconda che siano presenti due, tre o quattro doppi o tripli legami.
La catena deve essere numerata per determinare la posizione dei doppi o tripli legami. La numerazione deve essere fatta in modo da dare ai doppi o tripli legami il numero più basso possibile. In presenza di un doppio e un triplo legame, la precedenza va al doppio legame.

In idrocarburi ramificati si individua la catena più lunga di atomi di carbonio, che definisce la radice. Le catene laterali vanno intese come sostituenti ed elencate come prefissi utilizzando la nomenclatura dei radicali alchilici. I sostituenti vanno elencati in ordine alfabetico; davanti al nome va posto il nume che identifica la posizione nella catena. La numerazione va fatta in modo da dare ai sostituenti il numero più basso. In presenza di doppi o tripli legami la precedenza va ad essi.

4. Gli idrocarburi ciclici assumono il prefisso ciclo
Nomenclatura dei composti mono- e poli- funzionali
La presenza di un gruppo funzionale identifica l'appartenenza della molecola ad una classe di composti, designati da un suffisso (Tabella 2). Nei casi in cui il gruppo funzionale non faccia parte della catena principale si deve trattare come fosse un sostituente e si indica come prefisso

In composti polifunzionali il gruppo con priorità maggiore identifica l'appartenenza della molecola alla relativa classe di composti, che sarà designata dal suffisso; gli altri gruppi vengono trattati come sostituenti e indicati come prefissi.
Tabella 1. Nomenclatura degli idrocarburi alifatici
|
n° atomi C |
Radice Alc |
Alc ano R-H |
Alch ene R-H |
Alch ino R-H |
Radicale R Alch ile |
Radicale R Alch en ile |
Radicale R Alch in ile |
|
|
Met |
Met ano |
|
|
Met ile |
|
|
|
|
Et |
Et ano |
Et ene |
Et ino Acetilene |
Et ile |
Et en ile |
Et in ile |
|
|
Prop |
Prop ano |
Prop ene |
Prop ino |
Prop ile |
Prop en ile |
Prop in ile |
|
|
But |
But ano |
But ene |
But ino |
But ile |
But en ile |
But in ile |
|
|
Pent |
Pent ano |
Pent ene |
Pent ino |
Pent ile |
Pent en ile |
Pent in ile |
|
|
Es |
Es ano |
Es ene |
Es ino |
Es ile |
Es en ile |
Es in ile |
|
|
Ept |
Ept ano |
Ept ene |
Ept ino |
Ept ile |
Ept en ile |
Ept in ile |
|
|
Ott |
Ott ano |
Ott ene |
Ott ino |
Ott ile |
Ott en ile |
Oltt in ile |
|
|
Non |
Non ano |
Non ene |
Non ino |
Non ile |
Non en ile |
Non in ile |
|
|
Dec |
Dec ano |
Dec ene |
Dec ino |
Dec ile |
Dec en ile |
Dec in ile |
|
|
Undec |
Undec ano |
Undec ene |
Undec ino |
Undec ile |
Undec en ile |
Undec in ile |
|
|
Dodec |
Dodec ano |
Dodec ene |
Dodec ino |
Dodec ile |
Dodec en ile |
Dodec in ile |
Nomenclatura dei più comuni composti monofunzionali
|
Gruppo funzionale |
Molecola |
Prefisso |
Suffisso |
Classe di composti |
|
-X (F, Cl, Br, I) |
R-X |
Alo. |
Alchil alogenuro |
Alogenuri |
|
-OH |
R-OH, Ar-OH |
Idrossi. |
Alcanolo |
Alcoli, Fenoli |
|
-O- |
R-O-, Ar-O- |
|
Alcanolato |
Alcolati, Fenati |
|
-OR |
R'-OR |
Alcossi.. |
|
Eteri |
|
-O-R |
R'-O-R |
|
Alchil alchil' etere |
|
|
-SH |
R-SH, Ar-SH |
Solfidrile.. |
Alcantiolo (mercaptano) |
Tioli |
|
-S- |
R-S-, Ar-S- |
|
Alcantiolato |
Tiolati, tiofenati |
|
-SR |
R'-SR |
Tioalcossi |
|
Solfuri |
|
-S-R |
R'-S-R |
|
Alchil alchil' solfuro |
|
|
-NH2 |
RNH2 |
Ammino. |
Alchilammina |
Ammine |
|
|
R-CHO |
Formil. |
Alchilcarbaldeide |
Aldeidi |
|
|
R-CHO |
Oxo. |
Alcanale |
|
|
|
R'-CO-R |
Oxo.. |
Alcanone |
Chetoni |
|
|
R'-CO-R |
|
Alchil alchil' chetone |
|
|
|
R'-C(NH)-R |
Immino.. |
Alcanimmina |
Immine |
|
|
|
|
|
Acetali |
|
-CO-OH |
R-COOH |
Carbossi.. |
Acido alchilcarbossilico |
Acidi carbossilici |
|
-CO-OH |
R-CO-OH |
|
Acido alcanoico |
|
|
-CONH2 |
R-CONH2 |
Carbamoil.. |
Alchilcarbossiammide |
Ammidi |
|
-CONH2 |
R-CONH2 |
|
Alcanamide |
|
|
-CO-O- |
R-COO- |
Carbossilato. |
Alchilcarbossilato |
Carbossilati (sali) |
|
-CO-O- |
R-CO-O- |
|
Alcanoato |
|
|
-CO-OR |
R-CO-OR' |
Alcossicarbonil. |
Alchil' alchilcarbossilato |
Esteri |
|
-CO-OR |
R-CO-OR |
|
Alchil' alcanoato |
|
|
-CO-Cl |
R-CO-Cl |
Clorocarbonil. |
.Alchilarbonil cloruro |
Cloruri acilici |
|
-CO-Cl |
R-CO-Cl |
|
Alcanoil cloruro |
|
|
-CO-O-CO-R |
R-CO-O-CO-R |
|
Anidride alcanoica |
Anidridi |
|
|
|
Ciano.. |
Alchilcarbonitrile |
Nitrili |
|
|
|
|
.nitrile |
|
|
-NO2 |
R-NO2 |
Nitro.. |
|
Nitro composti |
Scala di priorità nella nomenclatura di composti polifunzionali
Acidi > Anidridi > Esteri > Cloruri acilici > Ammidi > Immidi > Nitrili > Aldeidi >_ Chetoni > Alogenuri > Ammine > Immine > Eteri > Doppi legami > Tripli legami
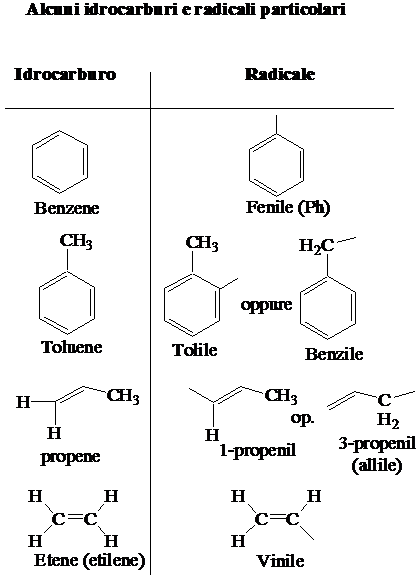
Alcuni composti polifunzionali




Come si scrivono le molecole?
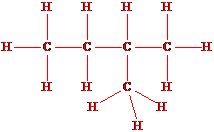
Consideriamo i vari modi di rappresentare una molecola semplice come il 2-metilpentano:
La formula bruta C5H10 non fornisce nessuna indicazione sulla struttura della molecola. In chimica organica le formule brute vengono usate solo raramente.
La formula di struttura compatta del tipo

è frequentemente usata, ma non è consigliata perché non fornisce informazioni sulla stereochimica.
La formula seguente NON E' ACCETTABILE: evidenziare i legami C-H è superfluo; gli angoli di legame non sono rispettati.
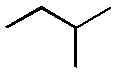
4) La formula di struttura a zig-zag è fortemente consigliata, poiché è veloce da scrivere e gli angoli di legame vengono rispettati. Formalmente, si ottiene proiettando sul foglio la molecola. I legami C-H non vanno scritti. Ad ogni vertice corrisponde un atomo di carbonio. Lo studente dovrà familiarizzare con questa simbologia.
Con questa simbologia è facile rappresentare molecole anche complesse. A titolo di esempio, consideriamo l'acido 2-ammino-3-cloro-4-metil-5-idrossiesanoico.

La radice esan indica una catena a 6 atomi di carbonio; la desinenza oico indica l'appartenenza alla classe degli acidi carbossilici; la numerazione della catena parte dal carbonio funzionale del carbossile. La molecola si scrive come si vede in proiezione sul piano.

Effetti elettronici dei gruppi funzionali
|
Gruppo funzionale |
Effetto induttivo I |
Effetto mesomero M |
Effetto complessivo |
Effetto su cationi e radicali |
Effetto su anioni |
|
Alchile -R |
Elettron repulsore +I |
nessuno |
Elettron repulsore |
|
|
|
Arile -Ar |
Trascurabile |
Elettron donatore +M Elettron accettore -M |
Elettron donatore Elettron accettore |
|
|
|
Vinile -CR=CR2 |
Trascurabile |
Elettron donatore +M Elettron accettore -M |
Elettron donatore Elettron accettore |
|
|
|
Ossidrile (-OH) Alcossi (-OR) |
Elettron attrattore -I |
Elettron donatore +M |
Elettron donatore (+M > -I) |
|
(+M assente) |
|
Solfidrile (-SH) Solfuro (-SR) |
Elettron attrattore -I |
Elettron donatore +M |
Elettron donatore (+M > -I) |
|
(+M assente) |
|
Ammino -NH2, -NHR, NR2 |
Elettron attrattore -I |
Elettron donatore +M |
Elettron donatore (+M > -I) |
|
(+M assente) |
|
Alogeno -X: |
Elettron attrattore -I |
Elettron accettore -M |
Elettron accettore (-I > +M) |
|
|
|
Carbonile* >C=O |
Elettron attrattore -I |
Elettron accettore -M |
Elettron accettore |
|
|
|
Ciano gruppo (-CN) |
Elettron attrattore -I |
Elettron accettore -M |
Elettron accettore |
|
|
|
Nitro (-NO2) |
Elettron attrattore -I |
Elettron accettore -M |
Elettron accettore |
|
|
*Carbonile in funzioni -CO-H, -CO-R, -CO-OH, -CO-OR, -CO-NH2
= effetto stabilizzante; = effetto destabilizzante
..perché il vinile e il fenile stabilizzano sia cationi che anioni?

Il legame p
CC può comportarsi sia da elettron accettore che da elettron donatore
.perché alogeni, ossigeno, azoto e zolfo hanno effetto elettron donatore +M?
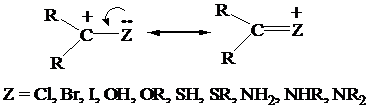
Gli atomi del 5, 6, e 7 gruppo hanno uno
(o più) doppietti di elettroni di non-legame che possono donare a un catione
...perché alogeni, ossigeno, azoto e zolfo hanno effetto elettron donatore -I?
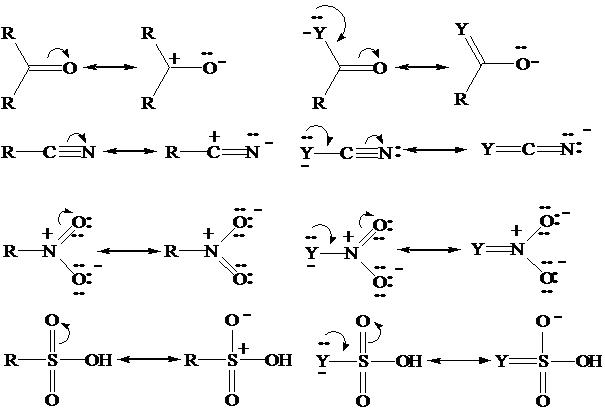
.perché i gruppi carbonile (di aldeidi, chetoni, acidi, esteri, ammidi,
anidridi, etc.), nitrile, nitro e solforile sono elettron
attrattori?
I legami multipli >C=O, -CsN, -N(O)=O e -SO3H sono fortemente polarizzati e possono ospitare elettroni rispettivamente sull'atomo di carbonio di carbonili e nitrili, azoto di n itro gruppi e solfo di gruppi solforili.

Isomeria

L'isomeria conformazionale nell'etano e negli etani sostituiti nasce dal fatto che gli atomi legati ai due atomi di carbonio possono assumere diverse posizioni reciproche. Poiché la differenza di energia tra le varie forme è molto bassa (1-3 Kcal/mol), i conformeri non possono essere separati.

A differenza dei cicloalcani a 3, 4 e 5 termini, che hanno struttura rigida, il cicloesano può assumere diverse conformazioni a causa della mobilità degli atomi di carbonio. Da notare che: a) la conformazione a sedia è più stabile di quella a barca, a causa della repulsione sterica tra gli atomi di idrogeno 1,4; b) si può passare da una all'altra per semplice rotazione dei legami s CC; c) nella conformazione a sedia ci sono 6 atomi di H che giacciono nel piano contenente i 6 atomi di C; questi sono detti equatoriali. Gli altri 6 atomi di H giacciono 3 sopra e 3 sotto il piano; vengono detti assiali; d) passando da una conformazione a sedia a un'altra gli H che erano assiali diventano equatoriali, e gli equatoriali diventano assiali; e) nei cicloesani sostituiti è preferita la conformazione in cui il sostituente è in posizione equatoriale; nella posizione assiale ci sarebbe interferenza (repulsione sterica) con gli altri due idrogeni assiali.


|

|
L'enantiomeria e la diasteroisomeria nascono dalla presenza nella molecola di uno o più stereocentri.
Sono stereocentri gli atomi di carbonio asimmetrici, ossia atomi di carbonio legati a 4 sostituenti diversi.
Uno stereocentro è chiamato anche centro chirale.
In un atomo di carbonio
asimmetrico (stereocentro) possiamo legare i 4 sostituenti in due modi diversi:
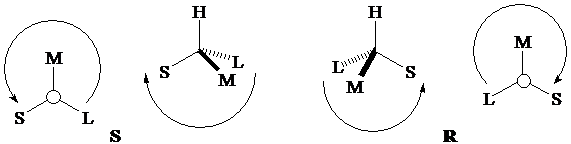
sono possibili
due configurazioni, chiamate R e S, che sono una l'immagine speculare dell'altra.
Per la determinazione della configurazione del carbonio asimmetrico:
definire i sostituenti L (large), M (medium), S (small) secondo le regole di priorità
ponendo l'atomo di idrogeno (o, comunque, il sostituente più piccolo) dentro il piano del foglio, andare idealmente da L a S passando da M. Se si va in senso orario, la configurazione è R (rectus); se si va in senso antiorario è S (sinister)
ponendo l'atomo di idrogeno (o, comunque, il sostituente più piccolo) fuori dal piano del foglio, andare idealmente da L a S passando da M. Se si va in senso antiorario, la configurazione è R (rectus); se si va in senso orario è S (sinister)
le regole di priorità tengono conto del peso atomico degli atomi A, B, C direttamente legati al carbonio; in caso di due atomi A e B uguali, si tiene conto del peso atomico dell'atomo più pesante legato a A e B
I > Br > Cl > S > O > N > C OR > OH SR > SH CH2R > CH3 CH=CR2 > CH2R
Enantiomeri. Quando in una molecola è presente uno stereocentro, sono possibili due stereoisomeri, uno immagine speculare dell'altro, chiamati enantiomeri. Un enantiomero ha configurazione R, l'altro configurazione S. Gli enantiomeri hanno le stesse proprietà chimiche e fisiche. Sono indistinguibili, tranne che per una proprietà: sono otticamente attivi, ossia ruotano il piano della luce polarizzata, un enantiomero a destra (destrogiro, d), l'altro a sinistra (levogiro, l). Poiché in senso assoluto l'angolo di rotazione a è uguale, una miscela equimolecolare d,l (detta miscela racemica, o racemo) è otticamente inattiva.

La capacità di ruotare il piano della luce polarizzata è detto potere rotatorio, a. Il potere rotatorio specifico, [a]D, è il potere rotatorio di una soluzione di 1 gr/mL, misurato per un cammino ottico di 10 cm alla riga gialla del sodio.
Diasteroisomeri. Quando in una molecola sono presenti due o più stereocentri, sono possibili tanti stereoisomeri quante sono le possibili combinazioni tra le diverse configurazioni degli stereocentri.
a) 2 stereocentri: 4 stereoisomeri, 2 diasterosiomeri, ciascuno presente come coppia di enantiomeri (RR/SS e SR/RS)
b) 3 stereocentri: 8 stereoisomeri, 4 diasterosiomeri, presenti come coppie di enantiomeri (RRR/SSS, RRS/SSR, RSR/SRS, RSS/SRR)
c) n stereocentri: 2n stereosiomeri, 2n/2 diasterosiomeri, presenti come coppie di enantiomeri
 |  |
||
 |
 |

Isomeria cis-trans nei cicloesani
1,2-disostituiti
 |
| Appunti su: precedenza ammide doppio legame, met et prop but tabella, https:wwwappuntimaniacomscientifichechimicala-nomenclatura-dei-composti-o14php, suffissi et prop, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |