 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3063 | Gradito: |
Leggi anche appunti:Il riempimento degli orbitaliIl riempimento degli orbitali Convenzionalmente ogni orbitale viene rappresentato MeiosiMeiosi La meiosi è il processo di divisione mediante il quale una cellula Regole di risonanzaRegole di risonanza La posizione relativa degli atomi (connettività) |
 |
 |
Un particolare tipo di interazioni intermolecolari possono essere considerate quelle che si manifestano tra ioni e molecole neutre, sia polari che apolari. L'intensità di tali interazioni è superiore a quella delle forze di van der Waals ((0.1 - 10 kJ mol-1), ma inferiore alle forze di legame (covalente, ionico e metallico) ed è dell'ordine di 101- 102 kJ mol-1.
Questa interazione è all'origine della solubilità delle sostanze ioniche in acqua. Durante il processo di idratazione (solvatazione) il catione attrae l'estremità negativa dei dipoli dell'acqua, l'anione l'estremità positiva. Il numero di molecole di acqua legate, denominato numero di idratazione dello ione, è direttamente proporzionale alla carica dello ione e inversamente proporzionale alla sua dimensione. Ioni piccoli come Li+, Na+, F , OH sono capaci di legare molecole di acqua nella prima sfera di idratazione e producono ordine anche oltre questa sfera, per questo si chiamano ioni strutturanti. Uno solido si scioglie se la sua energia reticolare è inferiore dell'energia di idratazione. I valori caratteristici di intensità di queste interazioni cadono nell'intervallo 40-600 kJ mol-1.

L'energia di interazione fra uno ione avente carica q e un dipolo permanente m, libero di ruotare (e quindi in fase fluida), ad una distanza r è
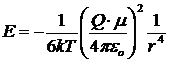
dove, al solito, il segno negativo indica che l'interazione è attrattiva, con
k = costante di Boltzmann = 1,38 10-23 J K-1
εo = costante delettrica del vuoto = 8,854 10-12 C2 m-2 N-1
T = temperatura assoluta
Ad esempio, a 25°C l'energia di interazione per uno ione monovalente (Q = 1,602 10-19 C) ed una molecola d'acqua con μ = 1,85 D (= 6,17 10-30 C m) alla distanza di 0.3 nm (= 3 10-10 m) è di

L'energia di interazione per una mole si ottiene moltiplicando il risultato precedente per il numero di Avogadro N = 6.022 1023 mol-1.
- 3,95 10-19 x 6.022 1023 = - 238000 J mol-1 = - 238 kJ mol-1
Per un dipolo stazionario l'energia di interazione con uno ione risulta inversamente proporzionale alla seconda potenza della distanza r e dipende dall'orientazione (angolo θ).


Il campo elettrostatico di uno ione è in grado di polarizzare un atomo o una molecola neutra ed apolare presente nelle vicinanze deformando la sua nuvola elettronica superficiale e generando un dipolo indotto, che subisce di conseguenza un'attrazione da parte della specie ionica.

L'intensità di questa interazione dipende dalla carica (Q) dello ione,
dalla polarizzabilità (![]() ) della molecola (o dell'atomo)
apolare e decresce con la quarta potenza della distanza (r).
) della molecola (o dell'atomo)
apolare e decresce con la quarta potenza della distanza (r).
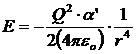
Ad esempio, a 25°C l'energia di interazione per uno ione monovalente (Q = 1,602 10-19 C) ed una molecola di tetraclorometano CCl4 con volume di poarizzabilità α' = 10.5·10-30 m3, alla distanza di 0.3 nm (= 3 10-10 m) è di
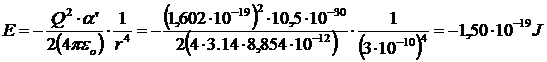
L'energia di interazione per una mole si ottiene moltiplicando il risultato precedente per il numero di Avogadro N = 6.022 1023 mol-1.
-1,50 10-19 x 6.022 1023 = - 90100 J mol-1 = - 90,1 kJ mol-1
Si tenga presente che: un dipolo indotto si origina sempre nell'interazione tra uno ione ed una molecola (sia essa polare o no). Se la molecola è polare, la forza di attrazione dovuta all'interazione ione-dipolo indotto si somma a quella dovuta all'interazione ione-dipolo permanente.
In conclusione si riportano i diversi tipi di legami intermolecolari e si confrontano con i legami interatomici covalente e ionico:
|
Tipo di interazione |
F(r) |
Energia tipica (kJ mol |
Esempio |
|
|
Ione-specie neutra |
Ione-Dipolo permanente |
r |
|
Na+ (H2O)n |
|
Ione-Dipolo indotto |
|
Na+ C6H6 |
||
|
tra specie neutre (van der Waals) |
Dipolo perm-Dipolo perm |
r |
|
SO2 SO2 |
|
Dipolo permanente-Dipolo indotto |
|
HCl C6H6 |
||
|
Dipolo istantaneo-Dipolo indotto |
|
CH4 CH4 |
||
|
Legame a idrogeno |
|
|
H2O HOCH3 |
|
|
Ione-Ione |
Legame ionico |
r |
|
Na+ Cl |
|
Atomo-Atomo |
Legame covalente |
|
|
H H |
 |
| Appunti su: interazione mole ola neutra molecola neutrra, interazioni tra molecole neutre, interazione fra ioni, solvatazione zanichelli, |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Ingegneria tecnico |  |