 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1640 | Gradito: |
Leggi anche appunti:Calcolo pH per acidi e basi fortiCalcolo pH per acidi e basi forti Il calcolo del pH per soluzioni contenenti Teoria di Lewis del legame covalenteTeoria di Lewis del legame covalente L'ipotesi del legame covalente come doppietto Cariche formaliCariche formali Per l'attribuzione delle cariche formali si procede come segue. |
 |
 |
(sale derivato da base forte ed acido debole)
Si produce un'idrolisi basica quando viene sciolto in acqua un sale il cui anione deriva da un acido debole, mentre il catione metallico deriva da una base forte.
Prendiamo ad esempio l'ipoclorito di sodio NaClO, che deriva dall'acido ipocloroso HClO (acido debole con ka piccola) e dall'idrossido di sodio NaOH (base forte con kb elevata).
In soluzione acquosa l'ipoclorito è, come la maggior parte dei sali, completamente dissociato in ioni Na+ e ioni ClO-
NaClO
![]() Na+ + ClO-
Na+ + ClO-
E' necessario ora analizzare in che modo tali ioni interferiscano con l'equilibrio di dissociazione dell'acqua
H2O ![]() H+ + OH-
H+ + OH-
Ora, mentre lo ione Na+ non ha alcuna tendenza a riassociarsi con l'anione OH- per dare l'idrossido di sodio indissociato, poiché NaOH è una base forte ed il suo equilibrio di dissociazione è completamente spostato verso destra;
NaOH → Na+ + OH-
l'anione ClO- presenta una grande tendenza a riassociarsi con gli ioni H+ prodotti dalla dissociazione dell'acqua per ridare l'acido ipocloroso, il cui equilibrio di dissociazione è invece fortemente spostato verso sinistra
H+ + ClO- → HClO
Poiché dunque lo ione ipoclorito ruba ioni H+ all'equilibrio di dissociazione dell'acqua, quest'ultima, per il principio di Le Chatelier, sposta il suo equilibrio verso destra producendo altri ioni H+ e naturalmente altrettanti ioni OH-. Naturalmente all'equilibrio, poiché gli ioni H+ vengono assorbiti dall'acido ipocloroso che si riassocia, in soluzione rimarrà un eccesso di ioni OH-.
Per calcolare il pH di tali soluzioni sarebbe necessario considerare congiuntamente i due equilibri che interferiscono, quello dell'acqua e quello dell'acido debole, in modo da soddisfare contemporaneamente le relative equazioni di equilibrio.
Se indichiamo con
y = la quantità di acqua che si dissocia liberando y mol/L di ioni OH- e y mol/L di ioni H+
x = la quantità di anione ipoclorito che si riassocia rubando x mol/L di ioni H+ per formare x mol/L di acido indissociato
C = concentrazione iniziale del sale = concentrazione iniziale dell'anione ipoclorito
![]()
![]()
Le due equazioni formano un sistema che richiede la soluzione di un'equazione di grado superiore al secondo.
|
Soluzione esatta Per calcolare il pH di tale soluzione sarebbe necessario tener conto simultaneamente dei seguenti due equilibri 1) H2O 2) HClO Nei 2 equilibri compaiono le seguenti 4 incognite. 1) [H+] 2) [OH-] 3) [HClO] 4) [ClO-] Dobbiamo pertanto scrivere 4 equazioni indipendenti nelle 4 incognite. Le prime due equazione si ricavano dalle equazioni di equilibrio rispettivamente dell'acido e dell'acqua
la terza si ottiene dal bilancio delle cariche (la somma di tutte le cariche positive deve essere uguale alla somma di tutte le cariche negative)
la quale, ricordando che il sale è completamente dissociato e quindi [Na+] = C, diventa
la quarta si ricavano infine dal bilancio di massa. Ricordando che il sale è completamente dissociato in C mol/L di ipoclorito ClO- e C mol/L di ioni sodio Na+, dopo l'idrolisi la somma dell'acido indissociato che si forma e dell'anione residuo all'equilibrio dovrà essere pari alla concentrazione iniziale C e potremo quindi scrivere
utilizzando le 4 equazioni ed effettuando le opportune sostituzioni si ottiene
con x = [H+] un'equazione di terzo grado che ci permette di calcolare il valore esatto della concentrazione totale di ioni H+ per una soluzione di un sale formato da un acido debole ed una base forte. |
Quando la concentrazione iniziale del sale è sufficientemente elevata, è possibile evitare di ricorrere alla soluzione esatta del problema, introducendo alcune semplificazioni nella trattazione.
Si ipotizza cioè che l'equilibrio dell'acido si sposti verso sinistra in misura pari allo spostamento verso destra dell'equilibrio dell'acqua. In altre parole per ogni molecola di acido che si forma dalla unione di un anione ClO- con un H+, una molecola d'acqua si dissoci per ridare lo ione H+ e uno ione OH-.
In questo modo si devono formare all'equilibrio tante molecole di HClO quanti ioni OH-.
In effetti ciò rappresenta solo una approssimazione in quanto in questo modo la concentrazione degli ioni H+ rimarrebbe inalterata, pari a 10-7, mentre la concentrazione degli ioni OH- crescerebbe ed il loro prodotto non soddisferebbe più la kw. In realtà parte degli ioni OH- si legano con gli ioni H+ in modo da soddisfare il prodotto ionico dell'acqua.
La concentrazione di equilibrio degli ioni OH- risulta pertanto leggermente inferiore di quella calcolata tenendo conto solamente della riassociazione dell'acido.
L'entità di tale processo è comunque minima e non influisce sulla concentrazione degli ioni OH- la quale è determinata essenzialmente dall'equilibrio dell'acido che si riassocia. Diviene necessario tener conto anche dell'equilibrio dell'acqua solo quando il sale è molto diluito.
La reazione semplificata che si ipotizza avvenga è detta reazione di idrolisi ed è la seguente
ClO- + H2O ![]() HClO + OH-
HClO + OH-
E' facile verificare che la sua costante di equilibrio, detta costante di idrolisi o kh, vale
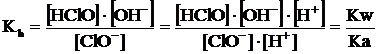
Tale relazione mette in evidenza come l'equilibrio di idrolisi basica è tanto più spostato verso destra quanto più l'acido è debole (maggiore tendenza ad associarsi liberando ioni OH-). Di conseguenza la soluzione risulterà essere tanto più basica quanto più piccolo è il valore della ka (e più elevato il valore della kh).
Per risolvere i problemi relativi agli equilibri di idrolisi si possono usare le stesse formule semplificate utilizzate per acidi e basi deboli monoprotici.
Esempio 1
Calcoliamo il pH di una soluzione 0,3 M di nitrito di potassio, sapendo che la ka dell'acido nitroso è pari 4,6.10-4 e di una soluzione 10-4 M del medesimo sale.
Il nitrito di potassio si dissocia completamente in 0,3 mol/L di ioni K+ e 0,3 mol/L di ioni NO2-.
KNO2 → K+ + NO2 -
L'anione nitrito tende a riassociarsi con gli ioni H+ provenienti dall'acqua producendo il seguente equilibrio di idrolisi
NO2- + H2O ![]() HNO2 + OH-
HNO2 + OH-
Calcoliamo la costante dell'equilibrio di idrolisi

Indichiamo con x la quantità di NO2- che si riassocia per dare x mol/L di HNO2, mentre vengono contemporaneamente liberate x mol/Ldi ioni OH-,
|
|
iniziale |
d'equilibrio |
|
[NO2-] |
|
0,3 - x |
|
[HNO2] |
|
x |
|
[OH-] |
|
x |
Esprimiamo le concentrazioni di equilibrio in funzione della costante di idrolisi
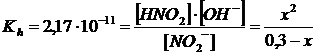
risolvendo l'equazione otteniamo
x = [OH-]= [HNO2] = 2,55.10-6 mol/L
[H+] = kw/ [OH-] = 3,92.10-9 mol/L pH = 8,4
(l'equazione di terzo grado fornisce [H+] = 3,91.10-9 mol/L)
Si noti come anche in questo caso sia possibile ricorrere ad una soluzione semplificata in quanto la concentrazione iniziale del sale è sufficientemente elevata e la kh è sufficientemente piccola da far ritenere che la quantità di ioni H+ che si riassocia sia trascurabile rispetto alla concentrazione dell'anione.
Se dunque trascuriamo la x nella differenza a denominatore, possiamo usare la seguente relazione semplificata
![]()
dove Csale è la concentrazione iniziale del sale.
Il prodotto (kh∙C) vale 6.5 10-12 ed essendo maggiore di 10-12 ci permette di usare la prima formula semplificata per il calcolo del pH
Nel caso della soluzione 10-4 M invece, il prodotto kh∙C
= 2.17 10-11 ∙ 10-4 = 6.5 10-15 < 10-12 e non possiamo quindi
usare la formula semplificata ![]() .
.
Poiché kh = 2.17 10-11 < 10-7
possiamo usare la seconda formula semplificata ![]()
![]()
[H+] = kw/ [OH-] = 9,065.10-8 mol/L pH = 7,04
(l'equazione di terzo grado fornisce [H+] = 9,063.10-8 mol/L)
Esempio 2
Calcoliamo il pH di una soluzione 3 10-2 M di carbonato di sodio Na2CO3, sapendo che le costanti di prima e seconda dissociazione acida dell'acido carbonico valgono rispettivamente ka1 = 4,3 10-7 e ka2 = 5,6.10-11 e di una soluzione 10-4 M del medesimo sale.
Il carbonato di sodio si dissocia completamente in 6 10-2 di ioni Na+ e 3 10-2 mol/L di ioni CO32-
Na2CO3 → 2Na+ + CO32-
L'anione carbonato tende a riassociarsi con gli ioni H+ provenienti dall'acqua producendo il seguente equilibrio di idrolisi
CO32- + H2O ![]() HCO3- + OH-
HCO3- + OH-
la costante dell'equilibrio di idrolisi è
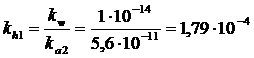
A sua volta l'anione bicarbonato HCO3- tende a riassociarsi con gli ioni H+ provenienti dall'acqua producendo un secondo equilibrio di idrolisi basica
HCO3- + H2O ![]() H2CO3 + OH-
H2CO3 + OH-
la cui costante di idrolisi vale
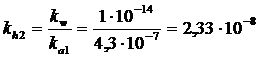
La prima costante di idrolisi ha un valore di circa quattro ordini di grandezza superiore alla seconda (kh1 >> kh2). Possiamo dunque trascurare il secondo equilibrio di idrolisi e trattare il primo come un equilibrio di dissociazione di una base debole al quale applicheremo la formula risolutiva semplificata più opportuna.
Soluzione 3 10-2 M
Poiché il rapporto C / kh1 = 3 10-2 / 1,79 10-4
= 1.7 102 > 102
ed il prodotto C ∙ kh1 3 10-2 ∙ 1,79 10-4 = 5.4 10-6 > 10-12 possiamo usare la formula semplificata ![]() .
.
![]()
pOH = -log(2,5 10-3) = 2,6
pH = 14 - pOH = 14 - 2,6 = 11,4
Soluzione 10-4 M
Poiché in questo caso il rapporto C / kh1 = 10-4
/ 1,79 10-4 = 0,56 < 102
non possiamo usare la formula semplificata ![]() . Essendo tuttavia C = 10-4 > 10-7
usiamo la relazione
. Essendo tuttavia C = 10-4 > 10-7
usiamo la relazione
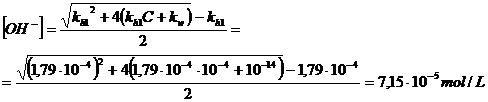
pOH = -log(7,15 10-5) = 4,1
pH = 14 - pOH = 14 - 4,1 = 9,9
 |
| Appunti su: |
|
| Appunti Biologia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Geografia |  |