 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1763 | Gradito: |
Leggi anche appunti:La mole ed il Peso molareLa mole ed il Peso molare Un concetto strettamente correlato al peso relativo Entropia di formazioneEntropia di formazione A differenza dell'energia libera di formazione (ΔGf) Misure della massa e della densità d'acqua e alcoolMisure della massa e della densità d'acqua e alcool Obiettivi: misurazione |
 |
 |
Fino ad ora abbiamo trattato soluzioni acquose, che sono sistemi omogenei, ma talvolta si presentano anche sistemi eterogenei in cui sono coinvolti equilibri eterogenei, molto importanti nella chimica analitica; generalmente questi sono legati alla presenza di sali poco solubili che, in quanto sali, sono sempre elettroliti forti (tanto più che la loro solubilità è molto bassa).
Consideriamo un sale poco solubile AB: questo si dissocia:
AB D A- + B+
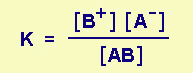
ma poiché il sale poco solubile è presente come corpo di fondo, la sua concentrazione [AB] (o meglio la sua attività) è costante, perciò
K [AB] = [A-] [B+] = KPS
KPS è chiamato prodotto di solubilità; essendo derivato da una K di equilibrio, è anch'esso una costante, a T costante, purché sia presente il sale come corpo di fondo (altrimenti non potremmo conglobare la sua attività nella costante).
KPS è strettamente legato alla solubilità s del sale (ricordiamo che solubilità = quantità massima del sale che può essere sciolta in una data quantità di solvente ad una certa T).
Poiché i sali sono elettroliti forti, la loro concentrazione in forma indissociata è costante ma assolutamente trascurabile: perciò la concentrazione degli ioni è ricavabile dalla solubilità del sale.
Se consideriamo un sale generico BnAm e ricordando che (s) significa solido, (aq) significa in soluzione acquosa, si possono individuare gli equilibri indicati in figura:

Fig.25.1 Equilibri di un sale poco solubile in fase solida, in soluzione acquosa, in forma ionizzata
Praticamente si fa riferimento all'equilibrio indicato con le frecce in rosso, data l'osservazione precedente; l'attività del sale è condizionata dalla presenza del sale come corpo solido in fase eterogenea rispetto alla soluzione, perciò alla sua solubilità s.
Prendiamo come esempio il fosfato tricalcico:
Ca3 (PO4)2 (s) D 3 Ca2+ + 2 PO43-
KPS = [Ca2+]3 [PO43-]2 = (3s)3 (2s)2 = 27 x 4 x s5
E' ovvia la necessità di usare i logaritmi in questi casi!
Volendo infatti ricavare la solubilità s conoscendo la KPS, si avrà:
s = (KPS /108)1/5 e passando ai logaritmi
lg s = 1/5 lg KPS - 1/5 lg 108
Sono noti i prodotti di solubilità di moltissimi sali poco solubili; per alcuni si tratta di valori veramente bassissimi (se si ricorda che la costante di Avogadro è circa 6x1023, si può calcolare che, per esempio per HgS, la solubilità è di 1 molecola in poco meno di 10.000 litri di soluzione!).
Si riportano, nella tabella, alcuni valori significativi di prodotti di solubilità a 25°C.
|
sale |
KPS |
|
sale |
KPS |
|
sale |
KPS |
|
CaSO4 |
2,4x10-5 |
|
BaSO4 |
1,1x10-10 |
|
FeS |
3,7x10-19 |
|
SrCrO4 |
3,6x10-5 |
|
AgCl |
1,6x10-10 |
|
ZnS |
1,2x10-23 |
|
Ca(OH)2 |
1,3x10-6 |
|
Ag2CrO4 |
1,2x10-12 |
|
PbS |
3,4x10-28 |
|
BaF2 |
1,7x10-6 |
|
AgBr |
7,7x10-13 |
|
Ag2S |
1,6x10-49 |
|
PbSO4 |
1,8x10-7 |
|
AgCN |
1,6x10-14 |
|
HgS |
1,6x10-54 |
|
CaCO3 |
8,7x10-9 |
|
AgI |
1,5x10-16 |
|
|
|
Fig.25.2 Prodotti di solubilità di alcuni sali
La conoscenza dei prodotti di solubilità (e della solubilità) ha molta importanza sia in chimica analitica (molte determinazioni qualitative e quantitative sfruttano queste caratteristiche) sia in chimica applicata (basti pensare ai problemi del degrado dei materiali lapidei calcarei e agli interventi per il restauro).
In particolare è interessante notare che dalla KPS del carbonato di calcio, costituente principale dei marmi, si può calcolare una solubilità di circa 9x10-5, mentre da quella del solfato di calcio, prodotto del degrado dei marmi a causa delle piogge acide, si ricava una solubilità di circa 5x10-3, cioè quasi 60 volte maggiore: per tale ragione, quando il carbonato viene trasformato in solfato dall'acido solforico trasportato dall'acqua piovana, parte del materiale viene dilavato. E questo è solo un esempio.
Ma se alla soluzione di un sale poco solubile viene aggiunto uno degli ioni costituenti il sale, che cosa succede?
Poiché a quella T, il KPS è costante, dovrà diminuire la concentrazione dell'altro ione (e dovrà precipitare, cioè separarsi dalla soluzione, una certa quantità di sale). Questo è detto effetto dello ione comune ed è una conseguenza del principio di Le Chatelier.
Prendiamo per esempio una soluzione di cloruro d'argento AgCl:
[Ag+] [Cl-] = 1,6 x 10-10
perciò
[Ag+] = [Cl-] = (1,6 x 10-10)1/2 = 1,265 x 10-5
Se ora aggiungo Cl- (per esempio sotto forma di NaCl) in concentrazione 10-2 M, avremo:
[Ag+] [Cl-] = [Ag+] (10-2 + 1,265 x 10-5) = 1,6 x 10-10
[Ag+] = 1,6 x 10-10/10-2 = 1,6 x 10-8
La concentrazione di Ag+ deve perciò ridursi di molto; precipiterà, sotto forma di AgCl tutto quello che è in eccesso.
Questo effetto viene utilizzato, per esempio, per ridurre la concentrazione di ioni pericolosi nelle acque di scarico industriali.
 |
| Appunti su: |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Ingegneria tecnico |  |