 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1803 | Gradito: |
Leggi anche appunti:L’elettronicaL’elettronica Par. 1) I semiconduttori Oltre che ai materiali isolanti Modello atomico di BohrModello atomico di Bohr La contraddizione del modello atomico planetario di Il valore del dubbio tra relativismo ontologico e relativismo gnoseologicoIl valore del dubbio tra relativismo ontologico e relativismo gnoseologico Tutta |
 |
 |
<<Due sole cose sono sicuro siano
infinite:
l’universo e la stoltezza umana…
e della prima non ne sono così sicuro>>
(A. Einstein)
La realtà è come un diamante ben intagliato, con un’incredibile varietà di facce e sfaccettature, ognuna delle quali, se illuminata da un solitario raggio di sole, si mostra ai nostri occhi con un diverso riflesso, un’immagine particolare, e quel diamante, nel suo prezioso, fulgido splendore, non riuscirà mai a nasconderci tutti quanti quei numeri che porta in sé più o meno nascosti e criptici.
Questi numeri e segnali sono nel suo interno, all’esterno, nel suo passato come nel suo futuro, liberi di muoversi ed evolversi, purché rimangano con la loro magnificenza in un eterno ed immobile presente.
Sin dagli albori della realtà, relazioni di tipo matematico si sono succedute ed hanno regolato i movimenti dei corpi, sin dal verificarsi del Big Bang, prima del quale non vi era neppure l’<<idea>> di numero o di spazio entro il quale pensarlo; prima del quale non esisteva nemmeno il pensiero o la <<materia>> o qualsiasi altra cosa che conosciamo.
 L’astronomo,
nonché fisico, statunitense Edwin Powell Hubble, grazie ai suoi approfonditi
studi, è arrivato alla teorizzazione di un rapporto matematicamente calcolabile
fra le distanze e le velocità di allontanamento delle diverse galassie.
L’astronomo,
nonché fisico, statunitense Edwin Powell Hubble, grazie ai suoi approfonditi
studi, è arrivato alla teorizzazione di un rapporto matematicamente calcolabile
fra le distanze e le velocità di allontanamento delle diverse galassie.
La relazione è:
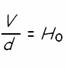
dove V è la velocità di allontanamento della galassia, calcolabile tramite lo studio degli spettri ricavati dallo studio della luce emanata da vari corpi celesti; d rappresenta la distanza dalla Terra in Megaparsec; Ho è la costante di Hubble, il cui significante oscilla fra i 50 e gli 80 km/s per 3,26 milioni di Anni Luce.
Questa importantissima relazione, per quanto possa sembrare vaga per un occhio inesperto, in quanto il valore di Ho ha un margine di approssimazione molto ampio, è in realtà alla base della teoria dell’universo inflazionario (o in espansione). Oltre questa relazione sono stati, poi, aggiunti altri elementi probatori a sostegno di questa tesi, come la radiazione fossile (o di fondo) scoperta, anzi rilevata nel 1965 dagli astronomi Penzias e Wilson, caratterizzata da una temperatura di circa 3K (cioè –270°C ), che si avvicina allo zero assoluto Kelvin (corrispondente alla temperatura di –273,15°C ) e che si espande quasi uniformemente sino ad i confini dell’universo. Pare sia l’ultimo afflato vitale rimasto sostanzialmente immutato dell’immane esplosione del Big Bang.
Ma cos’è precisamente la teoria dell’universo inflazionario?
Si sta parlando di qualcosa di grande e grandioso, della nascita della vita; è stato appurato, grazie alla scienza spettrografica e allo studio dell’effetto Doppler, (lo strano spostamento verso il rosso delle bande di colore dello spettro che aumenta gradualmente per le galassie più distanti) che tutte le galassie sono in movimento e si muovono in direzioni diverse e a velocità diverse e costanti. La causa di tale fenomeno è stata inizialmente oscura ed incomprensibile. Molti studi hanno portato alla teorizzazione di un movimento secondo radianti, in fuga da un punto x di origine, come un’ ideale intersezione di piani cartesiani tridimensionali dove sono siti i corpi celesti e che si amplia per far spazio alle particelle di materia viaggianti nello spazio cosmico.
 Mettendo a sistema i moduli di velocità, spostamento, rotazione ed
espansione di vari corpi celesti si scopre, infatti, che seguono le stesse
regole del fascio di rette passanti per uno ed un solo punto, ovviamente in un
sistema tridimensionale e fisico, e non bidimensionale e geometrico.
Mettendo a sistema i moduli di velocità, spostamento, rotazione ed
espansione di vari corpi celesti si scopre, infatti, che seguono le stesse
regole del fascio di rette passanti per uno ed un solo punto, ovviamente in un
sistema tridimensionale e fisico, e non bidimensionale e geometrico.
Ma precisamente cosa fu il Big Bang? cosa c’era prima? e cosa accadde dopo?
Il Big Bang fu di fatto l’atto del principio dell’universo, prima di esso nulla di ciò che esiste ora esisteva, neppure la materia, e neppure lo spazio esisteva; vi era solo in un punto ancora indeterminato del vuoto, qualcosa che vuoto non era, ma nemmeno pieno, era qualcosa di diverso, immensamente più piccolo di un atomo, ma ciò che di più grande esisteva in mezzo a quel nulla, un qualcosa da cui sarebbe nata la materia, lo spazio, le costellazioni, le galassie, i pianeti, la vita. Gli scienziati diedero un nome a questo qualcosa di misterioso ed affascinante, minuscolo e grandioso allo stesso tempo ed esso fu definito <<uovo cosmico>>.
In pratica era già allora tutto e nulla, cosa fosse con precisione assoluta non ci è dato saperlo; si sa soltanto che qualunque cosa lo riempisse aveva una pressione altissima ed inimmaginabile, tutta racchiusa in uno spazio quasi nullo e con gravità assai elevate. Tuttavia, dato che all’esterno non vi era niente da attrarre, la gravità era ininfluente, o forse addirittura inesistente. In condizioni simili le normali leggi della fisica non hanno valore. Di certo c’è solo che, in un dato momento, si creò uno squarcio nell’involucro dell’uovo cosmico e si verificò un’immensa esplosione senza eguali, il Big Bang. Decenni di studi hanno permesso di sapere, quasi nel dettaglio, quello che successe dal momento dello squarcio in poi, però solo in maniera puramente teorica, poiché in fondo non esiste nessun testimone oculare dell’accaduto (anzi, uno ci sarebbe: Qfwfq, il protagonista delle <<Cosmicomiche>> di Italo Calvino, ma di ciò parleremo in seguito) e la certezza è pur sempre molto relativa…
Ancora non esisteva un sole né un punto di riferimento né un sopra né un sotto né un levante né un ponente e non esisteva ancora neanche l’idea di tempo.
 Circa 15 miliardi di anni terrestri addietro esisteva solamente un
qualcosa di infinitamente piccolo, con infinita pressione e temperature di
miliardi e miliardi di gradi centigradi, l’uovo cosmico, energia allo
stato puro, che, senza un motivo apparente, si squarciò e provocò una
violentissima esplosione che in un tempo di 10ˉ³² secondi permise all’universo
di nascere e di appropriarsi di uno spazio migliaia di volte superiore
rispetto a quello dell’uovo cosmico. Tutta la pressione fornì una spinta
decisiva per l’energia fuoriuscita che riuscì a liberarsi da quel minuscolo
puntino e, mentre si allontanava, la temperatura scemò dalle incredibili cifre
di prima dell’esplosione ad un valore vicino allo zero assoluto e si
generò la “sfera di fuoco” che iniziò ad espandersi ad un ritmo un po’
più lento. Frattanto l’energia dispersa iniziò a raggrupparsi, nei primi 3
minuti dell’universo, in particelle atomiche elementari come i quark
(che ispirarono Piero Angela) e gli elettroni, seguiti poi dai protoni
e dai neutroni, che si unirono fra loro solo dopo che la temperatura
scese ad un miliardo Kelvin, e così rimase per circa 300.000 anni, con
qualche atomo di elio sparso fra le innumerevoli radiazioni, quando la
temperatura scese a 3.000K ed iniziò a formarsi l’idrogeno, il padre
della vita e della combustione stellare.
Circa 15 miliardi di anni terrestri addietro esisteva solamente un
qualcosa di infinitamente piccolo, con infinita pressione e temperature di
miliardi e miliardi di gradi centigradi, l’uovo cosmico, energia allo
stato puro, che, senza un motivo apparente, si squarciò e provocò una
violentissima esplosione che in un tempo di 10ˉ³² secondi permise all’universo
di nascere e di appropriarsi di uno spazio migliaia di volte superiore
rispetto a quello dell’uovo cosmico. Tutta la pressione fornì una spinta
decisiva per l’energia fuoriuscita che riuscì a liberarsi da quel minuscolo
puntino e, mentre si allontanava, la temperatura scemò dalle incredibili cifre
di prima dell’esplosione ad un valore vicino allo zero assoluto e si
generò la “sfera di fuoco” che iniziò ad espandersi ad un ritmo un po’
più lento. Frattanto l’energia dispersa iniziò a raggrupparsi, nei primi 3
minuti dell’universo, in particelle atomiche elementari come i quark
(che ispirarono Piero Angela) e gli elettroni, seguiti poi dai protoni
e dai neutroni, che si unirono fra loro solo dopo che la temperatura
scese ad un miliardo Kelvin, e così rimase per circa 300.000 anni, con
qualche atomo di elio sparso fra le innumerevoli radiazioni, quando la
temperatura scese a 3.000K ed iniziò a formarsi l’idrogeno, il padre
della vita e della combustione stellare.
Terminò quindi la fase della sfera di fuoco e, lentamente, gli atomi si avvicinarono e si condensarono e, attraverso vari fenomeni di tipo elettromagnetico, iniziò a nascere la materia, e da lì, dopo il primo miliardo di anni dal Big Bang, l’universo iniziò a conformarsi nella maniera in cui lo conosciamo oggi: nebulose, pianeti, stelle e gruppi di galassie più o meno distanti fra loro, masse oscure, buchi neri, quasar e quanto si può oggi rilevare grazie a sofisticatissimi telescopi spaziali.
Quando questa teoria fu descritta da Gamow negli anni Quaranta del XX secolo, l’astronomo F. Hoyle coniò ironicamente il nome “Big Bang” per scherno alla “stravagante” teoria del collega: il nome infatti sta a significare grande BANG, e <<BANG>> è il termine onomatopeico dell’esplosione utilizzato dai fumettisti come Carl Barks. In pratica, secondo Hoyle, la teoria dell’universo in espansione era errata.
Questa dell’universo in espansione fu anche fonte di ispirazione di Italo Calvino.
L’autore, come dichiarò in un’intervista del 22 dicembre 1965, scrisse una raccolta di “comiche” chiamata appunto <<Le Cosmicomiche>>, nel quale fanno da sfondo ai vari racconti comici (e la comicità è quella di Calvino) le varie leggi della fisica, dell’astronomia – tra le quali la fa da regina la teoria dell’universo in espansione capace di battere quella dell’universo stazionario nella novella <<Quanto scommettiamo?>> ed in tante altre – e le teorie scientifiche evoluzionistiche. Ma di questo parleremo dopo.
La teoria del Big Bang introduce ora una delle questioni fisiche ad oggi della maggior importanza: la termodinamica!
Il termine indica letteralmente la “dinamica del calore” e denomina quella branca della chimica-fisica che si occupa di descrivere le trasformazioni subite da un sistema in seguito a processi di trasformazione del calore in lavoro e viceversa.
 A Sadi Carnot si deve, nel 1824, la prima dimostrazione dei come sia
possibile ottenere lavoro da uno scambio di calore avvenuto fra due sorgenti a
temperature differenti. Grazie alle sue teorizzazioni, e tramite la sua macchina ideale, Carnot
quantificò questo lavoro, e quindi introdusse il concetto di rendimento
termodinamico.
A Sadi Carnot si deve, nel 1824, la prima dimostrazione dei come sia
possibile ottenere lavoro da uno scambio di calore avvenuto fra due sorgenti a
temperature differenti. Grazie alle sue teorizzazioni, e tramite la sua macchina ideale, Carnot
quantificò questo lavoro, e quindi introdusse il concetto di rendimento
termodinamico.
Il 1848 fu l’anno in cui Lord Kelvin, grazie alla macchina di Carnot, introdusse il concetto di temperatura termodinamica assoluta, ed anche un enunciato del secondo principio della termodinamica.
Nel 1850 Joule dimostrò quindi la diretta relazione esistente fra energia e calore (allora si credeva esistesse ancora il fluido calorico).
L'argomento di studio principale di questa disciplina sono i gas e le loro trasformazioni, in quanto queste stanno alla base delle cosiddette macchine termiche, ovvero apparati costruiti per convertire calore in movimento, energia in lavoro.
Sorse quindi il problema di come ristabilire la condizione di base: era possibile ottenere calore dal lavoro in modo totale, non era possibile ottenere l'inverso. La questione venne risolta da Clausius nel 1855, introducendo una disuguaglianza per distinguere i processi reversibili da quelli irreversibili e la funzione di stato entropia.
La differenza fra una trasformazione reversibile ed una irreversibile di un sistema termodinamico consiste nel fatto che, dopo aver avuto luogo, una reversibile può essere invertita riportando il sistema nelle condizioni iniziali senza che ciò comporti alcun cambiamento nel sistema stesso, una perdita di energia, mentre una irreversibile non può essere invertita senza una qualsivoglia dispendio di energia e, quindi, senza la conseguente modifica del sistema termodinamico preso in esame. In particolare, in una trasformazione reversibile è richiesto non solo che non avvenga una dissipazione di energia, ma che la trasformazione termodinamica sia essere quasi statica, ovvero effettuata con delle variazioni infinitesime delle condizioni del sistema in modo che questo possa essere considerato in equilibrio termodinamico in ogni istante.
Proprio perché caratterizzata da variazioni infinitamente minute, la trasformazione reversibile è irrealizzabile nella pratica, in quanto richiederebbe un tempo infinito per compiersi; essa rappresenta tuttavia un modello ideale, cui è possibile approssimare molte trasformazioni reali.
Per quanto riguarda l’entropia, il termine venne coniato da Rudolf Clausius nel 1864, e deriva dai termini greci εν, “dentro”, e τροπή, “cambiamento”. Il temine indicava infatti dove era convogliata l’energia fornita da un sistema, e, più precisamente, il legame esistente fra calore e meccanica (il calore è infatti determinato dalla somma degli incrementi di moto di particelle meccaniche). L’entropia dev’essere quindi definita come il rapporto tra le somme dei piccoli incrementi di calore (“infinitesimi” ), divisa per la temperatura assoluta (temperatura espressa in gradi kelvin, di cui già ci siamo occupati nella sezione della nascita dell’universo) che ha il corpo preso in esame durante il processo di assorbimento del calore.
 Ovviamente adesso si tratta di
un argomento non facilmente comprensibile solo in linea puramente teorica, e
quindi vi fornisco un esempio pratico.
Ovviamente adesso si tratta di
un argomento non facilmente comprensibile solo in linea puramente teorica, e
quindi vi fornisco un esempio pratico.
Immaginiamo un recipiente chiuso sulla sommità da un pistone che si può muovere liberamente verticalmente (su e giù). Dentro questo pistone c'è un gas, che consideriamo perfetto, ma dei gas perfetti parlerò dopo.
Possiamo descrivere lo stato del sistema utilizzando tre grandezze caratteristiche dei gas:
A questo punto è possibile riscaldare il gas, oppure comprimerlo (o espanderlo) muovendo il pistone, cosicché lo stato complessivo del sistema debba variare. Questo semplice esperimento è una trasformazione termodinamica.
Non è però possibile modificare a piacimento lo stato del gas, in quanto vi sono delle relazioni tra le varie grandezze: ad esempio non possiamo riscaldare il gas facendo restare costante sia la sua pressione che il suo volume. Bisogna quindi individuare le caratteristiche di un gas perfetto e le leggi che ne regolano le trasformazioni di stato.
Un gas perfetto è un modello innaturale di gas ideale, e ci si avvicinano solo i gas le cui molecole raggiungono l’ottetto nello strato di valenza. Un gas perfetto è, per definizione, un gas dove varrebbero le tre leggi fisiche dei gas perfetti (la legge di Boyle-Mariotte, la prima e la seconda legge di Gay-Lussac), ovvero dovrebbe essere un gas che rispetti l’univoca Legge dei gas perfetti (pV = nRT ) in qualsiasi condizione.
Per gas ideale si intende un gas che possieda le seguenti proprietà:
presenta molecole puntiformi;
vi sono interazioni delle molecole fra di loro e con le pareti del recipiente, interazioni caratterizzate da urti perfettamente elastici (ovvero quando non vi è dispersione di energia durante gli urti);
sono annullatele forze di interazione a distanza tra le molecole del gas;
identicit ed indistinguibilit fra le molecole del gas;
impossibilit di liquefazione del gas per sola compressione.
 In un gas ideale l'energia
cinetica media delle molecole del gas è direttamente proporzionale alla
temperatura:
In un gas ideale l'energia
cinetica media delle molecole del gas è direttamente proporzionale alla
temperatura:
![]()
I gas reali vengono descritti dalla legge dei gas perfetti con buona approssimazione solo quando la pressione è sufficientemente bassa e la temperatura sufficientemente alta. In caso contrario si usa la Legge dei gas reali.
Passiamo quindi ad esporre i vari tipi di trasformazioni termodinamiche tipiche dei gas ideali o perfetti.
Mi sembra giusto riportare l’egregia spiegazione del professor Francesco Zumbo:
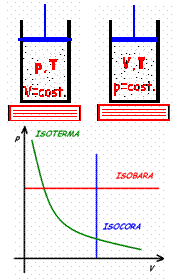
Trasformazione isoterma. Immaginiamo di immergere il pistone in un bagno di acqua a temperatura costante, che così mantiene anche il gas in equilibrio a quella temperatura. Possiamo quindi comprimere oppure far espandere il gas muovendo il pistone. Sperimentalmente si vede che vale la seguente relazione:
p·V = costante
Quindi pressione e volume sono, quando la temperatura resta costante, inversamente proporzionali, secondo una costante che dipende dalla quantità di gas contenuta nel cilindro.
Trasformazione isocora. Se blocchiamo il pistone in modo che questo non si possa muovere, e quindi riscaldiamo o raffreddiamo il gas fornendo o assorbendo calore, vediamo che la pressione all'interno del recipiente varia secondo questa relazione empirica:
p/T = costante
Quindi pressione e temperatura assoluta sono direttamente proporzionali. Si utilizza la temperatura assoluta, che si misura in kelvin, e non quella normalmente utilizzata, ovvero i gradi centigradi. La relazione che permette di convertire gradi centigradi in kelvin è:
TKelvin TCelsius
Trasformazione isobara. Se manteniamo costante la pressione del gas, ovvero se manteniamo libero il pistone di muoversi, vediamo che fornendo o assorbendo calore dal gas la sua temperatura varia e proporzionalmente anche il volume, secondo la relazione:
V/T = costante
Da queste tre relazioni si può ricavare un'espressione più generale, che tenga anche conto della quantità di gas contenuta nel cilindro. La legge di stato dei gas perfetti è quindi:
p·V = n·R·T
dove n è il numero di moli di gas nel cilindro, R è una costante caratteristica e vale:
R = 8,314 J/(mol·k)
È consuetudine rappresentare le trasformazioni e i vari stati di un gas in un grafico che riporta in ascissa il volume e in ordinata la pressione, detto per questo diagramma p-V. Le trasformazioni prima considerate si rappresentano quindi facilmente:
Ovviamente queste non sono le sole trasformazioni possibili, perché è possibile qualsiasi percorso nel grafico p-V, purché rispetti la legge di stato. In ogni caso queste tre trasformazioni sono quelle più semplici da descrivere e anche le più utili.
Intanto però conviene che discostiamo la nostra attenzione e passiamo a parlare dei quattro principi della termodinamica. I principi sono dei veri e propri assiomi, indimostrabili ma fondati sulla tangibile esperienza e base di tutti gli studi termodinamici. Vennero enunciati durante il corso del XIX secolo, e si suddividono in tre principi di base ed uno in loro insito, detto “principio zero della termodinamica”.
Principio Zero
L’esperienza insegna e la scienza conferma che quando due sistemi interagenti sono in equilibrio termico con un terzo sistema, i primi due sistemi sono in equilibrio tra loro. In pratica, se un corpo A è in equilibrio termico con un corpo B e B è in equilibrio termico con un corpo C A e C sono in equilibrio tra loro.
A=B ; B=C ; C=A
Tale principio spiega (anche se questo concetto non è presente nel principio zero) il fatto che due corpi, a temperature diverse, tra cui si scambia calore, finiscono per raggiungere la stessa temperatura: il punto d’incontro fra A e B è un terzo compreso fra i due, sarà C. Così A e B si vengono a trovare in equilibrio con un ideale C, come conseguenza degli urti delle particelle del corpo più caldo (mediamente più veloci), con le particelle del corpo più freddo (mediamente più lente), e si avrà allora un passaggio di energia dalle prime alle seconde. Da questa considerazione possiamo ora muoverci per la definizione del primo principio della termodinamica.
<<Per un sistema aperto, q-w=ΔE, ove per ΔE si intende la variazione di energia totale, che altro non è che la somma delle variazioni dell'energia interna, dell'energia cinetica e dell'energia potenziale possedute da quel sistema. Si vede che per un sistema chiuso le variazioni di energia cinetica e potenziale sono nulle per cui ci si riconduce alla relazione precedente>>
<<Per un ciclo termodinamico, q=w, dal momento che la variazione di energia totale è nulla, dovendo il sistema, al termine di ogni ciclo, ritornare nelle stesse condizioni di partenza>>.
Spero che queste dimostrazioni vi siano bastate per comprendere quanti numeri vi siano all’interno della realtà, e quanti di questi sono così sotto gli occhi di tutti da essere per molti aspetti invisibili.
Come? Ancora non siete soddisfatti?
Allora andiamo avanti, tanto gli esempi di numeri nascosti non mancano di sicuro, perché, in fondo, i numeri si sono veramente impadroniti del mondo!
 |
| Appunti su: |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Chimica |  |