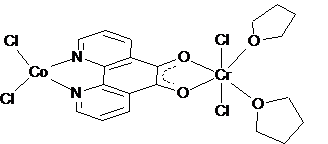Sintesi di CoCl2(N,N'-C12H6N2O2-O,O')CrCl2(THF)2
Il
complesso CoCl2(N,N′-C12H6N2O2),
(13), ha una reattività simile a quella del ferro. Esso, infatti
reagisce con CrCl2(THF)2 formando CoCl2(N,N′-C12H6N2O2-O,O′)CrCl2(THF)2
come descritto nell'equazione 2.34:
CoCl2(N,N′-C12H6N2O2)+CrCl2(THF)2
CoCl2(N,N′-C12H6N2O2-O,O′)CrCl2(THF)2 (2.34)
(23)
Questa reazione
è stata condotta in THF e necessita di condizioni di riflusso. Lo spettro IR
conferma la coordinazione del cromo al sito chinonico come dimostra la
scomparsa della banda a 1685 cm-1 attribuita allo stiramento del
sito chinonico non coordinato. La comparsa della banda a 1427 cm-1 è
invece attribuibile allo stiramento del legame C=O della funzionalità chinonica
del legante ridotta per un elettrone: abbiamo quindi un'ossidazione del Cr(II)
a Cr(III). Sulla base dei dati ottenuti spettroscopicamente e sulla base
dell'analisi elementare che conferma la formulazione del composto (23),
possiamo ipotizzare la struttura riportata in figura 2.26:
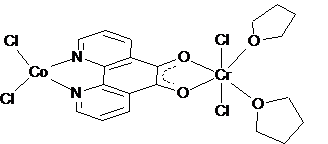
Figura
2. : Struttura ipotizzata per CoCl2(N,N′-C12H6N2O2-O,O′)CrCl2(THF)2
Il composto (23)
ha un momento magnetico di μ = 5,5 MB che coincide con la presenza di
quattro o cinque elettroni spaiati che potrebbe essere il risultato di un
accoppiamento tra gli elettroni spaiati del cobalto e quelli del cromo.
A differenza
del complesso (17) contenente il ferro, il composto (23) non può
essere sintetizzato facendo reagire dapprima il cromo al sito chinonico e
coordinando successivamente il cobalto a quello diimminico (eq. 2.35):
CrCl2(THF)2(O,O'-C12H6N2O2)
+ CoCl2 → solido marrone (2.35)
Lo spettro IR
del solido marrone risulta notevolmente diverso da quello descritto
precedentemente e mostra una maggiore somiglianza con lo spettro del composto
CrCl2(THF)2(O,O'-C12H6N2O2).
Si osserva infatti l'assenza della banda chinonica libera a 1685 cm-1
e la presenza della banda a 1427 cm-1 che conferma la riduzione del
chinone per un elettrone. Purtroppo, non possiamo affermare con sicurezza la
presenza del cobalto coordinato all'azoto diimminico in quanto la frequenza di
stiramento del legame C-N risente molto poco della coordinazione del centro
metallico.
Anche se i dati
riportati in letteratura indicano un maggior comportamento π-acido nel
momento in cui il metallo si coordina al sito chinonico lasciando libero quello
diimminico, la differenza fra gli andamenti delle reazioni 2.34 e 2.35 possono
trovare una spiegazione nella differente natura dei due alogenuri: CrCl2(THF)2
e CoCl2. Infatti mentre il primo ha una struttura monomerica, CoCl2
ha una struttura polimerica e quindi reagisce con più difficoltà con il
composto mononucleare di partenza (18). Inoltre l'insolubilità di CrCl2(THF)2(O,O'-C12H6N2O2)
rende ancora più complicata la coordinazione del cobalto al sito diiminico del
pdonq.
La mancata
coordinazione del cobalto al legante, è confermata dalla formazione di Co4Cl8(THF)6
già riportato in letteratura[ [i] nella
reazione 2.35. Tale composto, è stato infatti ottenuto in forma cristallina e
la sua natura è stata confermata mediante diffrazione di raggi X su cristallo
singolo (fig. 2.27)
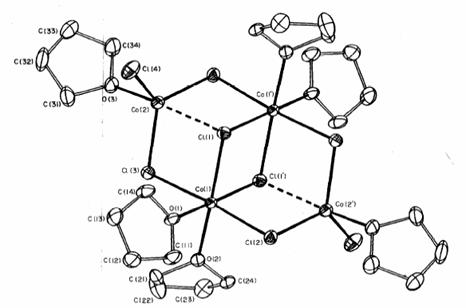
Figura
2. : Struttura molecolare di Co4Cl8(THF)6
Prima di
effettuare l'analisi EPR del composto (23), abbiamo ritenuto opportuno
verificare la sua stabilità in pirrolidone dal momento che esso è l'unico
solvente in grado di scioglierlo. Lo spettro IR del prodotto isolato per
precipitazione con THF da una soluzione di (23)
in pirrolidone, rivela la presenza di una banda a 1621 cm-1
attribuibile allo stiramento del gruppo ammidico del solvente coordinato al
centro metallico. In base ai valori dei numeri d'onda della banda di stiramento
del legame C=O ammidico del pirrolidone coordinato, è possibile dimostrare che
esso si coordina al centro di cromo. Infatti il trattamento di CoCl2(N,N′-C12H6N2O2)
con pirrolidone dà origine ad un composto di formula CoCl2(N,N′-C12H6N2O2)(pirr)0,6
che mostra la banda di stiramento C=O del gruppo ammidico a 1640 cm-1.
Tale assorbimento si sposta a 1621 cm-1 nel caso di CrCl2(pirr)2(O,O'-C12H6N2O2).
Dal momento che il composto (23) mostra la banda di stiramento C=O a
1621 cm-1, si può concludere che il solvente si coordina sul centro
metallico di cromo(III).
Lo spettro EPR
riportato in figura 2.28, registrato in pirrolidone (conc. 1,21·10-3
M) a temperatura ambiente, rivela la presenza di due segnali attribuibili ai
centri metallici di cromo e cobalto.
- La specie 1 contenente cromo in
concentrazione relativa 96%è caratterizzata da giso
= 1,9708 e larghezza di riga 9.6 Gauss (94% Lorentziana, 6% Gaussiana)
- La specie 2 contenente cobalto in concentrazione relativa 4% è
caratterizzata da giso = 1,9798 e larghezza di
riga 1.4 Gauss (100% Lorentziana)
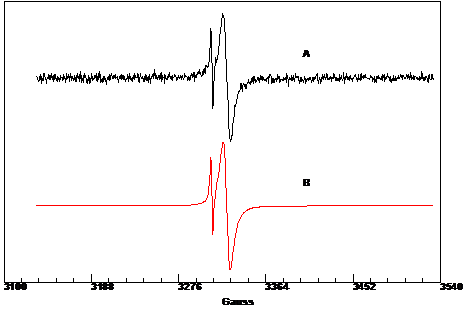
Figura 2. : Spettro EPR di CoCl2(N,N′-C12H6N2O2-O,O′)CrCl2(THF)2
a294 K; A) sperimentale, B) simulato.
Al diminuire
della temperatura si osserva una variazione della larghezza di riga. In
particolare si nota una diminuzione della larghezza di riga della specie
contenente il cromo, ed un aumento della larghezza di riga della specie
contenente il cobalto senza che le concentrazioni relative cambino. I dati
relativi allo spettro riportato in figura 2.29 possono essere così riassunti:
La specie contenente il cromo in
concentrazione relativa del 96% è caratterizzata da giso
= 1,9708 e larghezza di riga 6,1 Gauss (100% Lorentziana)
La specie contenente cobalto in
concentrazione relativa del 4% è caratterizzata da giso
= 1,9798 e larghezza di riga 1.5 Gauss (100% Lorentziana).
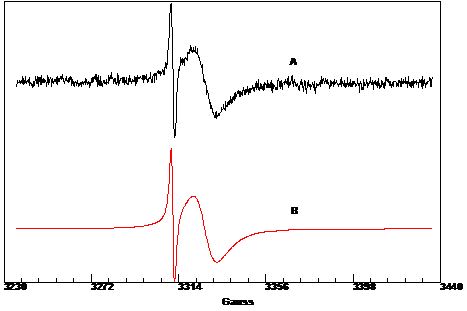
Figura 2. : Spettro EPR di CoCl2(N,N′-C12H6N2O2-O,O′)CrCl2(THF)2
a254 K; A) sperimentale, B) simulato.
Da questi
spettri si nota che i due centri metallici di cromo e cobalto si comportano
come se facessero parte di due sistemi indipendenti l'uno dall'altro. L'ipotesi
più plausibile è quindi che in soluzione il composto (23) possa
scindersi dando vita a due specie di cui una è attribuibile al derivato
mononucleare CrCl2(THF)2(O,O'-C12H6N2O2)
e l'altra, presente in concentrazione relativa del 4%, è attribuibile ad un
addoto che il cobalto(II) forma con il pirrolidone,Co4Cl8(pirr)6
(in analogia con l'addotto che il cobalto forma con il THF) con una geometria
tale da essere visibile all'EPR nonostante i tempi di rilassamento brevi del
cobalto.




![]()