 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 6283 | Gradito: |
Leggi anche appunti:Il modello di bohrIL MODELLO DI BOHR Bohr ebbe il merito importante di riuscire a descrivere La cellula eucariote animaleLa cellula eucariote animale La cellula eucariote animale è formata da una Rappresentazione delle molecoleRappresentazione delle molecole I composti organici possono essere rappresentati attraverso |
 |
 |
I protidi o proteine o polipeptidi sono le sostanze chimiche che svolgono i compiti più svariati all'interno della cellula. Possiamo comunque ricondurre le funzioni proteiche all'interno di due principali attività: a) strutturali o plastiche b) di regolazione o controllo.
Vi è una stretta correlazione fra forma e funzione delle proteine.
Le proteine con funzione plastica hanno una forma fibrosa. Sono costituite da catene polipeptidiche allungate, disposte in fasci lungo uno stesso asse a costituire le fibre. Sono insolubili in acqua.
Le proteine con funzione di regolazione e controllo hanno invece una forma globulare. Le catene sono strettamente avvolte in forma compatta, sferica o globulare, come un gomitolo. Sono solubili in acqua.
Esiste un numero enorme di proteine, una diversa dall'altra, sia all'interno di uno stesso organismo, sia tra organismi di specie diverse, ma tutte sono ottenute attraverso la combinazione di 20 mattoni chimici: gli amminoacidi. Il fatto che le proteine siano diverse e caratteristiche per ogni individuo e per ogni specie è legato al fatto che esse vengono sintetizzate a partire dalle informazioni genetiche contenute nel DNA
Oltre ai venti amminoacidi comuni a tutte le proteine di tutti gli esseri viventi, ve ne sono alcuni specifici di alcune proteine (l'ossiprolina del collagene) e alcuni che svolgono da soli azioni fisiologiche particolari (ormone tiroxina).
I 20 amminoacidi comuni a tutti gli esseri viventi si legano a formare lunghe catene proteiche, ognuna costituita da qualche centinaio di amminoacidi.
Il nostro organismo non è in grado di sintetizzare 8 amminoacidi, per questo detti amminoacidi essenziali, che devono essere pertanto introdotti con la dieta.
Tali amminoacidi sono particolarmente abbondanti nelle proteine di origine animale che, per questo motivo, sono dette 'nobili', rispetto a quelle di origine vegetale.
Tutti gli amminoacidi che costituiscono le proteine presentano la seguente struttura generale

Un carbonio centrale tetraedrico (detto carbonio alfa) al quale è legato un gruppo amminico (-NH ) di natura basica, un gruppo carbossilico (-COOH) di natura acida, un atomo di idrogeno ed un gruppo chimico (-R), detto residuo amminoacidico o gruppo R, diverso da amminoacido ad amminoacido.
Gli amminoacidi si legano tra loro a formare le proteine tramite un legame di condensazione, facendo reagire il gruppo amminico di un amminoacido con il gruppo carbossilico di un altro, con perdita di una molecola di acqua.

Il legame che si produce è detto legame peptidico ed il gruppo chimico CONH è detto gruppo peptidico.
![]()
gruppo peptidico
In questo modo tutte le proteine si presentano costituite da un lungo filamento chimico comune, formato dalla successione di gruppi CH e CONH, dal quale sporgono i residui amminoacidici (-R), la cui successione è diversa da proteina a proteina. Tale successione definisce la peculiare struttura primaria di una proteine.

Convenzionalmente la struttura primaria si rappresenta iniziando con il gruppo amminico e terminando con il gruppo carbossilico. Il primo amminoacido della sequenza è detto amminoacido N-terminale (enne-terminale o ammino-terminale), l'ultimo amminoacido C-terminale (ci-terminale o carbossi-terminale).
Sequenze di pochi amminoacidi (50 - 100) sono dette peptidi. Oltre un certo limite (diverso da autore ad autore: PM 5.000 - 10.000 uma) si parla di polipeptidi.
I filamenti proteici non rimangono mai lineari. Rispondendo alle sollecitazioni prodotte dalle loro polarità interne si ripiegano su se stessi formando strutture a diverso grado di complessità. Sono stati descritti per le proteine 4 livelli strutturali principali.

Ogni proteina si differenzia dalle altre essenzialmente per la sua struttura primaria, cioè per la particolare sequenza di amminoacidi che la caratterizza.
Non appena un filamento proteico viene sintetizzato esso passa subito in struttura secondaria. Tale struttura si produce grazie alla possibilità di rotazione dei gruppi CH rispetto ai gruppi peptidici (CONH) lungo tutto il filamento.
La rotazione è invece impedita lungo il legame peptidico C-N che presenta un parziale carattere di doppio legame (vi è risonanza tra il doppio legame C=O ed il legame singolo C-N).

Gli atomi del gruppo peptidico (CONH) giacciono tutti su di un medesimo piano. Questi piani possono ruotare rispetto al carbonio-alfa. In questo modo, ogni piano delle unità peptidiche ha due rotazioni possibili: una intorno al legame tra il carbonio-alfa e l'atomo di azoto del gruppo peptidico C-N (angolo di rotazione Φ, fi), l'altra intorno al legame tra l'atomo di carbonio-alfa e l'atomo di carbonio del gruppo peptidico C-C' (angolo di rotazione ψ, psi).

Tali rotazioni permettono al filamento proteico di avvolgersi su se stesso secondo schemi diversi, raggiungendo una struttura finale stabile.

Vi sono diversi tipi di configurazioni secondarie, tutte rese stabili da ponti idrogeno che si instaurano tra i gruppi peptidici che la torsione interna del filamento porta uno di fronte all'altro (l'idrogeno fa da ponte tra due elementi molto elettronegativi: l'azoto e l'ossigeno).

Ma per motivi di reciproco ingombro sterico dei grossi gruppi laterali R e affinché sia ottimizzata la stabilizzazione del filamento attraverso la formazione di legami Idrogeno intracatena, gli angoli ψ e Φ possono assumere solo determinati valori e di conseguenza il filamento proteico assume solo certe configurazioni secondarie. In altri termini, ogni struttura secondaria è caratterizzata da particolari valori degli angoli ψ e Φ.
In sintesi, sono dunque due i fattori che determinano la struttura secondaria di una proteina e che hanno l'effetto di rendere minima l'energia potenziale della molecola:
minimizzazione dell'ingombro sterico fra i gruppi R
ottimizzazione della formazione di legami H intracatena
Il risultato di queste restrizioni fa sì che gli elementi di struttura secondaria si possano ricondurre sostanzialmente a tre sole diverse tipologie stabili: alfa-elica, foglietto-beta e ripiegamenti (loop). Nelle rappresentazioni proteiche schematiche questi tre elementi strutturali vengono visualizzati rispettivamente come spirali (o cilindri), frecce e fili curvilinei

a) Struttura secondaria ad elica (helix)
Nelle proteine possono esistere diverse conformazioni ad elica, ma tra queste la più rappresentativa è certamente l'alfa-elica (elica).
L'alfa-elica è il risultato della conformazione secondaria probabilmente più 'naturale' che una catena peptidica possa assumere e rappresenta pertanto l'elemento di struttura secondaria più comune nelle proteine.
Il filamento proteico si avvolge a formare una spirale (una specie di molla) resa stabile dai ponti idrogeno che si formano tra spira e spira. In un'alfa-elica, i legami ad idrogeno dello scheletro sono organizzati in modo che il C=O dell'ennesimo gruppo peptidico punti verso l'N-H del (n+4)mo gruppo peptidico. Ciò produce un forte ponte ad idrogeno che presenta una lunghezza N---O quasi ottimale di 2,8 Å
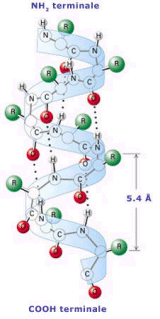
I residui amminoacidici (-R) sporgono esternamente al filamento spiralizzato (elica). La distanza tra spira e spira (passo) è di 5,44 Å, il raggio dell'elica è di 2,3 Å ed in ogni spira sono presenti 3,67 amminoacidi (Pauling e Corey). L' alfa-elica presente nelle proteine è quasi sempre destrorsa
b) Struttura secondaria a foglietto beta (-sheet
Nella struttura secondaria beta il filamento proteico (strand) presenta un andamento a zig-zag Le configurazioni beta per il loro andamento caratteristico vengono anche dette a foglio pieghettato (pleated sheet). I gruppi peptidici formano le pagine del foglio, mentre gli atomi di carbonio tetraedrico (C) formano le pieghe con i residui amminoacidici che si presentano alternati sempre in corrispondenza della parte concava della piega (angolo maggiore di 180°).

Molto spesso nelle proteine, due o più filamenti beta (β-strands) tendono ad affiancarsi lateralmente ed a legarsi tramite ponti a idrogeno, generando strutture estese, pieghettate, dette foglietti β.

Nei foglietti β, i filamenti possono essere orientati reciprocamente in senso antiparallelo o parallelo. In quest'ultimo caso, i foglietti sono meno stabili e si incontrano pertanto più raramente nella struttura delle proteine.

La 'geometria' dei legami a idrogeno è diversa a seconda che questi uniscano filamenti con orientamento antiparallelo o parallelo. Nel primo caso sono perpendicolari all'asse dei filamenti (e risultano quindi ottimali per direzionalità) e più corti.

L'orientamento indicato dalle frecce è quello convenzionale, ovvero nella direzione NH2 COOH

Normalmente i foglietti β non sono planari, ma tendono ad assumere nell'insieme una forma incurvata e lievemente 'avvitata'.

Torsione destrorsa di due
filamenti in un foglietto beta
c) Strutture secondarie: Ripiegamenti (turn) ed anse (loop)
Oltre ai due elementi regolari di struttura secondaria appena descritti, nelle proteine sono presenti tratti di catena coinvolti in ripiegamenti 'a gomito' che invertono la direzione della catena polipeptidica permettendole di ripiegarsi nella struttura terziaria.
Questi tratti, definiti ripiegamenti ed anse, fanno da collegamento fra alfa-eliche o filamenti β ed hanno un ruolo assai importante nella organizzazione 3D della catena peptidica (struttura terziaria). Nelle proteine in struttura terziaria queste configurazioni curvilinee arrivano a rappresentare circa un terzo delle strutture secondarie presenti.
Molto comuni sono le brevi curve di 3-5 residui (β-turns) che collegano due filamenti β consecutivi, orientati in modo antiparallelo.
In queste strutture secondarie curvilinee è quasi costante la presenza degli amminoacidi glicina e/o prolina.
La glicina, presentando un Idrogeno come gruppo R e quindi un limitato ingombro sterico, può assumere angoli ψ e Φ non consentiti ad altri amminoacidi. La glicina può così avere un ruolo importante nella struttura proteica, potendo far assumere alla catena angolazioni 'insolite'.
La prolina è in realtà un imminoacido poichè al posto del gruppo amminico -NH2, presenta il gruppo imminico -NH-. Quando la prolina entra a far parte di una proteina il gruppo imminico perde il suo unico idrogeno nella formazione del legame peptidico. In questo modo non si forma un gruppo peptidico CONH, ma un gruppo CON. In tali condizioni non può dunque formarsi il legame idrogeno e le strutture secondarie regolari (eliche e foglietti) risultano instabili in corrispondenza dei punti in cui si trova la prolina.
Le proteine sono state classificate storicamente in fibrose (o filamentose) e globulari, in relazione alla loro morfologia generale. Questa suddivisione è legata ai vecchi metodi utilizzati per la determinazione della struttura della proteina su scala atomica e non fa giustizia delle proteine che contengono sia regioni estese e filamentose che regioni più compatte, altamente ripiegate e globulari. Tuttavia tale classificazione permette di sottolineare le proprietà delle proteine fibrose, insolubili, che hanno spesso un ruolo protettivo, connettivo o plastico negli organismi viventi. Le proteine fibrose meglio caratterizzate, la cheratina, la miosina, la fibroina ed il collagene, sono molecole allungate la cui conformazione è dominata da un singolo tipo di struttura secondaria. Sono quindi esempi utili di questi elementi strutturali.
Le cheratine sono il componente fondamentale degli annessi cutanei degli animali (capelli, peli, unghie, corna strati superficiali della pelle, piume, etc.)
L'unità della cheratina è costituita da una coppia di alfa-eliche destrorse strettamente superavvolte (coiled-coil) in senso sinistrorso e rinforzate da numerosi ponti disolfuro intercatena.

A loro volta queste unità si avvolgono fra loro a formare strutture di ordine superiore ( protofilamenti, protofibrille e filamenti).
Uno schema tipico è il '9 + 2', con due protofibrille centrali circondate in modo regolare da nove protofibrille a formare un filamento. Un singolo capello è formato da numerosi di questi filamenti.
Il collagene è una proteina che per le sue eccezionali doti di resistenza alla trazione va a costituire gran parte del tessuto connettivo (tendini, cartilagini, derma, etc). L'unità fondamentale del collagene, il tropocollagene, è una struttura elicoidale superavvolta (coiled-coil) con andamento destrorso, formata da tre catene polipeptidiche (tripla elica), ciascuna delle quali ha una struttura secondaria ad elica sinistrorsa (elica del collagene), diversa dall'alfa-elica.
L'elica del collagene, oltre ad essere
sinistrorsa, è infatti più 'stirata' (ha un passo quasi doppio
rispetto all'alfa-elica) ed ha un diametro inferiore, avendo solo tre residui
amminoacidici per giro.
Ogni singola catena è formata da circa 1000 amminoacidi ed è pressoché
completamente avvolta ad elica.
|
|
La torsione opposta delle eliche (simile a quella di una fune ritorta) conferisce al collagene notevoli proprietà di rigidità, un elevato carico di rottura e la possibilità di mantenere costante la sezione sotto tensione. |
La struttura tipica dell'elica del collagene è dovuta alla particolare sequenza amminoacidica delle catene, che è costituita per oltre un terzo da glicina e per almeno un quinto da prolina e idrossiprolina.
Esistono diversi tipi di collageno, ma in
tutti quanti si ritrova una ripetizione monotona di triplette con sequenza Gly-X-Y,
in cui X è spesso Prolina e Y è spesso Idrossiprolina.
Ogni 'terzo' residuo della catena è quindi una glicina e solo questa
presenza, in questa posizione, rende possibile il superavvolgimento
estremamente compatto della tripla elica.
Le unità del tropocollagene si organizzano in fibre, disponendosi in maniera sfalsata, parallelamente, lungo l'asse della fibra. La fibra è resa ancor più resistente e rigida dalla formazione di legami crociati, di tipo covalente, che si instaurano fra residui di lisina o di istidina delle unità e anche all'interno della stessa unità, tra le singole catene polipeptidiche.
Il collagene cambia facilmente di forma se riscaldato, Diventa solubile e forma facilmente soluzioni colloidali (collagene = che genera colla).
La fibroina è la proteina della seta. A differenza di collagene e cheratina, la fibroina ha una struttura beta, organizzata in estesi foglietti, pieghettati a ventaglio.
La fibroina è ricchissima di alanina e glicina,
che si alternano nella sequenza primaria.
Ciò consente ai foglietti β di disporsi in piani sovrapposti,
ravvicinati e compatti, tenuti insieme da deboli interazioni apolari fra i
residui laterali di alanina e glicina. Questa particolare organizzazione rende
la seta morbida e flessibile.

La miosina, una delle due proteine che costituiscono le fibre muscolari, ha una struttura mista: è costituita da due catene pesanti, che si organizzano in una lunga coda fibrosa (costituita da due alfa-eliche superavvolte) e in due teste globulari, alla cui composizione concorrono anche quattro catene leggere.

Strutture supersecondarie: motivi e dominii
Praticamente in tutte le proteine di cui sia
nota la struttura 3D, gli elementi fondamentali di struttura secondaria si
trovano combinati in particolari motivi strutturali di struttura
supersecondaria.
I motivi strutturali più ricorrenti sono i seguenti:


Le catene proteiche che contengono più di 200 residui amminoacidici si piegano solitamente in due o più agglomerati globulari noti come dominii, che danno a queste proteine un aspetto bi- o multilobato.

I dominii sono in genere formati dall'aggregazione di diverse strutture secondarie ed hanno spesso una funzione specifica come il riconoscimento sterico di una piccola molecola.

Gliceraldeide 3-fosfato deidrogenasi
Il dominio in rosso lega il NAD+
Il dominio in verde lega la gliceraldeide
La maggior parte delle proteine, dopo aver raggiunto la struttura secondaria, subisce un ulteriore processo di torsione. Avvolgendosi ulteriormente su se stesse, tali proteine formano una specie di matassa globulare, caratteristica della struttura terziaria. detta struttura nativa. Per la loro configurazione compatta le proteine in struttura terziaria vengono dette proteine globulari.
Il processo di ripiegamento (folding) dei filamenti secondari è reso possibile dalla formazione di snodi lungo il filamento stesso.
Come abbiamo visto, tra le cause alla base della formazione di tali snodi o gomiti vi è la presenza dell'amminoacido prolina. La prolina è in realtà un imminoacido poichè al posto del gruppo amminico -NH2, presenta il gruppo imminico -NH-. Quando la prolina entra a far parte di una proteina il gruppo imminico perde il suo unico idrogeno nella formazione del legame peptidico. In questo modo non si forma un gruppo peptidico CONH, ma un gruppo CON. In tali condizioni non può dunque formarsi il legame idrogeno e la struttura secondaria risulta quindi instabile in corrispondenza dei punti in cui si trova la prolina.
Le articolazioni che in tal modo si formano (ripiegamenti ed anse) consentono a tratti diversi del filamento secondario di avvicinarsi reciprocamente interagendo attraverso i residui amminoacidici. Le interazioni idrofile ed idrofobiche tra i residui, e tra questi e l'acqua in cui le proteine normalmente si trovano, costringono il filamento proteico a contorcersi. La proteina si aggroviglia fino a raggiungere una forma a globulo, in cui i residui amminoacidici polari si trovano alla superficie (a contatto con l'acqua), mentre i residui amminoacidici apolari si introflettono all'interno del globulo. Tale disposizione, diminuendo il rapporto superficie/volume e concentrando i gruppi polari sulla superficie esterna, rende in genere solubile la proteina.

La struttura globulare viene poi ulteriormente stabilizzata da legami interni alla molecola. Tra questi tipi di interazioni, le più frequenti sono:
Particolarmente diffusi sono i ponti disolfuro (-S-S-) che si formano tra due gruppi solfidrilici -SH (il gruppo solfidrile è presente solo nell'amminoacido cisteina).

In tal modo una proteina globulare risulta particolarmente irregolare, presentando una superficie ricca di incavi, anfrattuosità e sporgenze. Ogni proteina globulare presenta delle irregolarità caratteristiche (sito attivo o sito di riconoscimento) che utilizza in modo peculiare per riconoscere una specifica sostanza chimica (substrato) ed effettuare su di essa azioni biologiche specifiche. Il riconoscimento è altamente selettivo ed avviene secondo un modello chiave-serratura.


E' per questo motivo che ogni cambiamento di struttura e quindi di forma può sconvolgere completamente la funzionalità proteica. Ad esempio le variazioni di pH, modificando la distribuzione di polarità nei residui amminoacidici, possono influenzare drasticamente il modo in cui una proteina si ripiega su se stessa, modificandone la struttura.
Per le loro caratteristiche di solubilità e per l'azione di riconoscimento altamente specifica, le proteine globulari svolgono negli organismi importantissime funzioni di regolazione, di controllo e di trasporto. Vediamone alcuni esempi.
1) Gli anticorpi, prodotti da particolari globuli bianchi (linfociti), sono in grado di riconoscere ed agganciare sostanze estranee e potenzialmente pericolose (antigeni), consentendo all'organismo di eliminarle.
2) Gli enzimi sono dei catalizzatori biologici, molecole in grado di riconoscere, agganciare e modificare chimicamente una sostanza chimica (reagenti), aumentando la velocità con cui la reazione avviene.
Come tutti i catalizzatori anche gli enzimi non si consumano durante la reazione, ma si ritrovano inalterati al termine di ciascun ciclo di catalisi. E' per questo motivo che essi risultano efficaci anche in piccolissime concentrazioni.
Ogni enzima riconosce in modo specifico il suo substrato ed esiste quindi un enzima specifico per ogni reazione che deve avvenire in una cellula.
Senza gli enzimi la maggior parte delle reazioni all'interno delle cellule sarebbe talmente lenta da non essere compatibile con la sopravvivenza dell'organismo.
Attraverso gli enzimi inoltre, la cellula controlla in un dato momento quali reazioni devono essere eseguite e quali no. In tal modo gli enzimi funzionano come veri e propri interruttori biologici: quando l'enzima è presente la reazione avviene, quando l'enzima è eliminato la reazione rallenta al punto da produrre effetti trascurabili.
In genere gli enzimi catalizzano le reazioni legandosi temporaneamente con altre molecole dette coenzimi o cofattori. Molto spesso i coenzimi non sono molecole proteiche. La parte non proteica di una proteina composta è detta gruppo prostetico. Molti coenzimi derivano chimicamente dalle vitamine, molecole indispensabili al nostro metabolismo che dobbiamo giornalmente introdurre in piccole dosi tramite l'alimentazione.
Mentre gli enzimi riconoscono la sostanza da catalizzare (specificità di substrato), il coenzima effettua su di essa la modificazione chimica (specificità di azione). Uno stesso coenzima può legarsi ad enzimi diversi, conservando la sua specificità di azione ed effettuando così la stessa reazione su substrati diversi. Gli enzimi hanno desinenza -asi.
|
Famiglia |
Reazione catalizzata |
|
Ossidoreduttasi |
Ossidoriduzioni |
|
Transferasi |
Trasferimento gruppi chimici |
|
Idrolasi |
Idrolisi |
|
Liasi |
Addizione a doppio legame |
|
Isomerasi |
Conversione tra isomeri |
|
Ligasi |
Formazione legami con consumo ATP |
|
|
Catalisi Durante una reazione, sia esoergonica che endoergonica, i reagenti si trasformano nei prodotti di reazione attraverso uno stadio intermedio (stato di transizione), altamente instabile, che possiede un'energia superiore sia dei reagenti che dei prodotti di reazione. La differenza di energia tra lo stato di transizione ed i reagenti è detta "energia di attivazione". Maggiore è l'energia di attivazione, più lenta è la reazione. I catalizzatori (e quindi anche gli enzimi) hanno la proprietà di abbassare l'energia di attivazione di una reazione e quindi di renderla più veloce. |
3) Gli ormoni sono molecole secrete nel sangue dalle nostre ghiandole endocrine (le ghiandole esocrine secernono fuori dal sangue). Esistono ormoni proteici ed ormoni steroidei (derivati dal colesterolo). Gli ormoni hanno il compito di regolare svariate funzioni di cellule, tessuti ed organi, inibendole o stimolandole. Ogni ormone deve essere in grado di "riconoscere" specificatamente il tipo di cellule sulle quali agire (cellule bersaglio). Per questo motivo le cellule presentano sulla loro membrana esterna particolari molecole di riconoscimento (recettori di membrana) che rappresentano il substrato al quale si lega il sito attivo dell'ormone.
4) Le proteine di trasporto (carriers) sono in grado di agganciare e trasportare specifiche sostanze chimiche. Alcune di queste proteine sono disciolte nel sangue e trasportano sostanze per via ematica. Altre sono immerse nella membrana cellulare (proteine transmembraniche o integrali) e permettono alla cellula di scambiare sostanze con l'ambiente esterno. Queste ultime si dividono in pompe e canali. Le pompe consumano energia per effettuare il trasporto (trasporto attivo), mentre i canali sono in grado di trasportare sostanze attraverso la membrana senza consumare energia (trasporto passivo).
La Mioglobina è un esempio classico di proteina globulare di trasporto. Svolge la propria funzione nel muscolo, dove costituisce una riserva di ossigeno, prontamente disponibile per le fibre muscolari. E' un esempio di proteina coniugata che, a differenza delle proteine semplici, contiene un gruppo prostetico di natura non proteica: il gruppo ferro-eme, deputato al legame dell'O2.
La mioglobina è una proteina relativamente piccola, costituita da 153 amminoacidi. Quasi l'80% della catena polipeptidica ha una struttura ad -elica.
Nella conformazione 3D sono riconoscibili otto distinte strutture ad -elica (A, B, C, D, E, F, G, H, in direzione N →C), ripiegate in modo apparentemente irregolare, ma caratteristico e tale da creare una tasca idrofobica che accoglie il gruppo prostetico ferro-eme.
È probabile che l'idrofobicità della tasca che ospita il gruppo eme sia di estrema importanza per il mantenimento dello stato ridotto dello ione Fe2+ e quindi della funzionalità della proteina. Lo ione Fe3+ è infatti incapace di legare l'ossigeno ed è stato osservato che il Fe2+-eme libero in soluzione ha una spiccata tendenza ad ossidarsi spontaneamente a Fe3+.

Il gruppo eme è un complesso coordinato, formato da una porfirina sostituita (protoporfirina IX) e lo ione Fe2+.
La porfirina
presenta una struttura planare costituita da quattro anelli di pirrolo
(un eterociclo pentatomico contenente un atomo di azoto), uniti da ponti
metinici (-CH-).
Lo ione Fe2+ si trova al centro della struttura, legato con quattro
dei suoi sei legami di
coordinazione ai quattro atomi di azoto del tetrapirrolo.
Legandosi con un altro
legame di coordinazione ad un residuo di istidina (detta F8, perché è
nell'ottava posizione dell'elica F), il Fe àncora saldamente alla proteina
l'intero gruppo eme.
Il sesto legame di coordinazione del Fe è quello che lega la molecola di
O2. Al legame dell'ossigeno contribuisce anche una istidina
(E7), mediante un ponte Idrogeno.
Oltre che nella mioglobina, l'eme è presente nell'emoglobina e nei citocromi (proteine che trasportano elettroni nella catena respiratoria), nella clorofilla e nella vitamina B12. In queste due ultime molecole il Fe è tuttavia sostituito rispettivamente da Mg e Co.

Il gruppo eme
5) I marcatori ed i recettori sono particolari proteine di membrana, che permettono alla cellula di scambiare segnali chimici con l'ambiente esterno. I recettori sono in grado di ricevere informazioni agganciandosi con molecole esterne come gli ormoni o i neurotrasmettitori secreti dalle cellule nervose (neuroni). I marcatori sono molecole che le cellule espongono come segnali chimici per altre cellule. Ne sono un tipico esempio i marcatori che le cellule del nostro organismo espongono per farsi riconoscere e non farsi attaccare dalle cellule del nostro sistema immunitario.
Per buona parte delle proteine, la struttura
terziaria rappresenta l'ultimo livello di organizzazione strutturale.
È il caso delle proteine cosiddette monomeriche, costituite cioè da un'unica unità funzionale,
biologicamente attiva.
Molte altre proteine (ad esempio, un gran numero di enzimi), nella loro forma attiva sono invece costituite dall'associazione di due o più unità di struttura terziaria (dette monomeri o subunità), uguali (proteine omo-oligomeriche) o diverse (proteine etero-oligomeriche).
Si parla in tal caso di struttura quaternaria, per riferirsi all'organizzazione multimerica della proteina.
Nella struttura quaternaria, le subunità sono tenute insieme da interazioni generalmente non covalenti, spesso di natura idrofobica.
Raramente, più catene peptidiche sono unite da legami covalenti, come accade ad esempio nelle immunoglobuline (una classe di anticorpi), in cui le catene leggere e pesanti sono tenute insieme da ponti disolfuro.
Altrettanto insolito è il coinvolgimento diretto di legami a ponte di idrogeno nell'associazione di più subunità. Nella struttura quaternaria infatti, le subunità tendono ad affiancarsi in modo da contrapporre l'una all'altra le loro porzioni idrofobiche, rivolgendo verso l'esterno le regioni polari, idrofile.
L' emoglobina è un esempio
classico di una proteina in struttura quaternaria. La proteina è un tetramero
costituito dall'associazione di due catene
(141 amminoacidi) e due catene β (146 amminoacidi),
ciascuna delle quali lega un gruppo eme.
Il gruppo eme contiene un atomo di ferro in grado di legarsi debolmente ed
in modo reversibile con l'ossigeno (O ). L'emoglobina è una proteina di
trasporto in grado di trasferire i gas respiratori dai polmoni ai tessuti e
viceversa.

emoglobina
Le subunità sono tenute insieme da numerose interazioni idrofobiche e da diversi legami a idrogeno che rendono la struttura quaternaria assai stabile.
Contenendo quattro gruppi eme, l'emoglobina può legare fina a 4 molecole di O2. Ma il fatto notevole è che essa ha la capacità di modulare la propria affinità per l'ossigeno in funzione della concentrazione (pressione parziale) dell'ossigeno stesso.
Ciò è possibile grazie alla struttura oligomerica della proteina. Il legame di una molecola di O2 ad una subunità provoca infatti una variazione conformazionale nelle subunità adiacenti, tale da far aumentare la loro affinità per l'ossigeno (la loro capacità di legare l'ossigeno). Maggiore è il numero di subunità che legano l'ossigeno, più cresce l'affinità degli altri siti di legame.
Questo fenomeno, comune a molti enzimi oligomerici, prende il nome di cooperatività.
L'emoglobina si caratterizza per il fatto di produrre una curva di saturazione in funzione della concentrazione del substrato con un caratteristico andamento sigmoide (a forma di esse). La mioglobina, proteina monomerica, non può ovviamente presentare il fenomeno della cooperatività e, legando l'ossigeno sempre con la stessa affinità, obbedirà ad una cinetica classica, con una tipica curva di saturazione iperbolica.

La differente cinetica di legame dell'ossigeno rende le due proteine particolarmente adatte allo specifico ruolo che esse devono svolgere come trasportatori di O2.
L'emoglobina ha il compito di 'fare il pieno' di ossigeno in un distretto dove la pO2 (pressione parziale dell'ossigeno) è elevata (alveoli polmonari) e rilasciarlo facilmente in quei distretti in cui la pO2 è relativamente bassa (tessuti periferici).
Se avesse le caratteristiche della mioglobina, fosse cioè in grado di legare l'O2 con affinità elevata, ma costante, l'emoglobina potrebbe assolvere bene il primo compito, ma non il secondo. Come si può desumere dal grafico, un trasportatore come la mioglobina (P50 = ca. 3 mmHg), raggiungerebbe una saturazione pressoché completa (ca. 97%) negli alveoli polmonari, ma resterebbe saturo per circa il 90% nei capillari e quindi non potrebbe cedere facilmente l'ossigeno ai tessuti.
L'aspetto veramente critico dell'intera questione risiede nel fatto che la differenza della pressione parziale dell'ossigeno nei due distretti non è poi così rilevante: varia infatti solo di un fattore tre fra alveoli polmonari e capillari.
Solo una proteina con una cinetica
cooperativa potrebbe assolvere in maniera ottimale la funzione di trasportatore
di ossigeno dai polmoni ai tessuti periferici.
Qualche numero servirà a rendere più evidente la straordinaria efficienza
dell'emoglobina nello svolgere il compito che le è assegnato.
L'emoglobina ha una P50 pari a ca.
30 mmHg, più o meno la pO2 presente nei capillari, dove l'emoglobina
ha pertanto una saturazione intorno al 50%. Se la sua affinità rimanesse
costante, negli alveoli polmonari essa raggiungerebbe a malapena il 75% di
saturazione; viceversa, grazie al fenomeno della cooperatività, è in grado di
raggiungere una saturazione quasi completa.
D'altro canto, la mioglobina, mantenendo costantemente elevata la propria
affinità, può svolgere adeguatamente il ruolo di riserva di ossigeno,
prontamente disponibile, nei tessuti periferici.
L'emoglobina ha anche l'importante funzione di trasportatore di CO2. La CO2 viene trasportata come carbammato, legato all'-NH2 del gruppo N-terminale di ciascuna catena

Esistono anche proteine in struttura quaternaria in cui le subunità si aggregano a formare, come le perle di una collana, strutture filamentose che svolgono in genere funzioni strutturali. Ne sono tipici esempi l'actina e la tubulina.
L'actina è costituita da numerosi monomeri globulari (G-actina), associati a formare una coppia di lunghi filamenti, avvolti a spirale fra loro (F-actina).

Nel sarcomero, l'unità contrattile delle fibre muscolari, diverse molecole di miosina si associano in fasci, con le teste sfalsate, a costituire i cosiddetti filamenti spessi; mentre le molecole di actina, associate con altre due proteine (tropomiosina e troponina) formano i filamenti sottili.

Lo scorrimento reciproco dei filamenti di actina e di miosina producono l'accorciamento del sarcomero e la conseguente contrazione muscolare
La tubulina è una proteina costituita da un eterodimero formato da una subunità ed una subunità . L'unità dimerica polimerizza a spirale formando dei microtubuli. Ciascun microtubulo risulta formato da 13 protofilamenti paralleli in cui le subunità alfa e beta si alternano. La cellula è in grado di montare e smontare i microtubuli molto rapidamente, aggiungendo o togliendo le unità dimeriche. I microtubuli vengono utilizzati dalla cellula per scopi diversi (ciglia, flagelli, fuso mitotico, citoscheletro) che verranno trattati in seguito.

 |
| Appunti su: curva saturazione emoglobina, protidi riassunto, i protidi riassunto, proteine fibrose, emoglobina struttura quaternaria, |
|
| Appunti Biologia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Geografia |  |