 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1558 | Gradito: |
Leggi anche appunti:Serie di bowenSERIE DI BOWEN In funzione del contenuto in silice, il magma viene definito Sintesi di cocl2(n,n'-c12h6n2o2-o,o')crcl2(thf)2Sintesi di CoCl2(N,N'-C12H6N2O2-O,O')CrCl2(THF)2 Il complesso CoCl2(N,N′-C12H6N2O2), (13), Costante di velocità specifica ed equazione di ArrheniusCostante di velocità specifica ed equazione di Arrhenius Nel 1889 il chimico |
 |
 |
L'atomo di idrogeno, sulla base dei dati sperimentali, possiede:
- un nucleo con una carica positiva e quasi tutta la massa dell'atomo
- un elettrone con una carica negativa e che si muove attorno al nucleo
Nucleo ed elettrone interagiscono elettrostaticamente; l'energia totale Etot del sistema è costituita da due componenti, energia potenziale Epot ed energia cinetica Ecin
Etot = Epot + Ecin
Epot è l'energia dovuta alla mutua posizione nucleo-elettrone in ogni istante;
Ecin è l'energia dovuta al movimento dell'elettrone.
Etot, in assenza di perturbazioni (dovute ad acquisto o perdita di energia da parte del sistema), è costante e corrisponde a quella dell'atomo nello stato fondamentale (n=1) a più bassa E.
|
Fig.6.1 Modello dei livelli energetici dell'elettrone di un atomo di idrogeno. Per assorbimento di E quantizzata l'atomo può passare agli stati eccitati (che hanno cioè n > 1) ; poi in 10-12 s, per emissione di E quantizzata, può tornare a n = 1. Stati stazionari sono il complesso totale di stati, cioè il fondamentale più quelli eccitati (cioè, praticamente la loro sommatoria Si ni) Emax = 0 rappresenta il limite corrispondente alla ionizzazione: in questa situazione infatti Epot = 0, (l'elettrone è 'infinitamente' lontano dal nucleo, perciò non esiste alcuna interazione tra loro) Ecin = 0 (l'elettrone è 'fermo', gli viene cioè data l'energia per allontanarlo dal nucleo fino a distanza 'infinita', ma nulla di più che gli permetta di muoversi; questo 'di più' sarebbe energia continua e non più quantizzata). |
|
Nel modello energetico l'energia E viene intesa come negativa, poiché la consideriamo come una E di stabilizzazione.
Per descrivere il comportamento dell'elettrone attorno all'atomo possono essere utili delle funzioni matematiche che tengano conto del campo di potenziale in cui si trova l'elettrone; ma il campo è condizionato dalla posizione istantanea dell'elettrone rispetto al nucleo e questa è rappresentabile con un sistema di coordinate cartesiane in cui l'origine degli assi coincide con il centro del nucleo M.
|
|
|
Fig.6.2 Posizione dell'elettrone e rispetto alle tre coordinate cartesiane la cui origine è costituita dal nucleo dell'atomo M. La posizione dell'elettrone, rispetto a questo sistema di riferimento, è definita, in ogni istante, da una terna di valori (xi, yi, zi). Una rappresentazione perfettamente equivalente dal punto di vista operativo può essere ottenuta anche mediante coordinate polari. |
|
|
|
Fig.6.3 Erwin Schrödinger |
Nel 1926 Erwin Schrödinger (1887-1961; premio Nobel nel 1933) sviluppò una equazione differenziale la cui soluzione è la funzione desiderata, cioè quella che rappresenta la posizione dell'elettrone rispetto alla sua energia; questa funzione ψ è chiamata funzione d'onda.
L'equazione differenziale é:
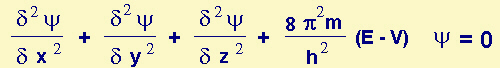
in cui: (d2ψ / dx2), (d2ψ/ dy2), (d2ψ / dz2) sono le derivate seconde parziali della funzione Ψ rispetto alle direzioni x, y e z;
m è la massa dell'elettrone;
E è l'energia totale dell'elettrone (Etot);
V è l'energia potenziale dell'elettrone (Epot);
è la funzione d'onda
E' evidente che il termine (E-V) rappresenta l'energia cinetica (Ecin)
Sia E sia Ψ sono incognite; trattandosi perciò di una equazione a due incognite, esisteranno infinite soluzioni dell'equazione: ad un certo valore per l'energia (detto autovalore) Ei, corrisponderà una certa funzione Ψ i (detta autofunzione).
Potremo perciò conoscere l'energia dell'elettrone in funzione dei suoi spostamenti (in effetti la cosa è più complessa, ma in prima approssimazione questo può essere sufficiente).
Queste Ψ, per gli atomi, possiamo chiamarle orbitali. Ad ogni stato stazionario corrisponde una Ψ i e perciò una ben determinata Ei.
Le varie Ψ possono avere, tra l'altro, anche 'forme' speciali diverse. Ciò dipende da parametri che sono chiamati numeri quantici.
 |
| Appunti su: |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |