 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2426 | Gradito: |
Leggi anche appunti:Il Processo DryIl Processo Dry Il primo processo di realizzazione della doppia giunzione Dissociazione dei SaliDissociazione dei Sali Come abbiamo già detto la maggior parte dei sali sono Le forme furanosiche e piranosiche del Fruttosio |
 |
 |
Sappiamo che esistono sostanze che conducono la corrente elettrica.
Le migliori sono i metalli (lo si capisce ricordando le caratteristiche del legame metallico), detti conduttori di I specie: se sottoposti a una ddp (differenza di potenziale), in essi avviene passaggio di elettroni, che trasportano cariche, ma non materia.
L'intensità della corrente elettronica dipende dalla resistenza R del conduttore.
Altre sostanze sono gli elettroliti, le cui soluzioni trasportano corrente, con trasferimento anche di materia, mediante gli ioni; sono detti conduttori di II specie. A questa classe appartengono anche i sali fusi e alcuni liquidi puri (come acido solforico puro e ammoniaca liquida, che presentano il fenomeno dell'autoprotolisi come l'acqua).
L'esistenza di ioni positivi e negativi è stata postulata da Arrhenius nel 1883 (Nobel 1903).
Gli elettroliti forti (sali, idrossidi alcalini e alcalino-terrosi, che sono ionici anche nello stato solido, acidi forti, etc.), in soluzione acquosa sono dissociati completamente, o quasi, in ioni.
Gli elettroliti deboli invece sono poco dissociati (per esempio molti acidi organici).
L'acqua è un ottimo solvente per sostanze ionizzabili purché la solvatazione porti ad un guadagno energetico che compensi l'energia di rottura dei legami attrattivi che esistono in fase solida.
Potremo perciò avere, per molecole polari (anche se a struttura covalente, non ionica) una reazione di dissociazione, favorita dall'acqua, che può essere totale o parziale.
HCl + H2O D H3O+ + Cl- totale
NH3 + H2O D NH4+ + OH- parziale
H2SO4 + H2O D H3O+ + HSO4- totale
HSO4- + H2O D H3O+ + SO42- parziale
Gli ioni sono solvatati da altre molecole di acqua.
Se in una soluzione di elettroliti immergiamo due lamine metalliche e ad esse imponiamo una forza elettromotrice fem (o differenza di potenziale ddp), si ha passaggio di corrente e, alle due lamine, che si chiamano elettrodi, avvengono processi chimici.
|
Fig.27.2 Rappresentazione schematica di una apparecchiatura costituita da una soluzione di elettroliti in cui sono immerse due lamine metalliche sottoposte a ddp mediante una pila. Gli ioni positivi (cationi) vanno verso il catodo che si trova a potenziale elettrico più basso (catodo dal greco kata = sotto). Gli ioni negativi (anioni) verso l'anodo, a potenziale più alto (anodo dal greco ana = sopra). All'interfaccia catodo-soluzione si ha una riduzione (assorbimento di elettroni e-); all'anodo invece ossidazione (cessione di elettroni). Gli elettroni ceduti, sotto l'effetto della forza elettromotrice passano dall'anodo verso il catodo attraverso un circuito metallico esterno e seguono perciò un percorso da destra a sinistra. Avremo così un flusso di cariche elettriche che avviene in parte nel circuito esterno (elettroni) e in parte in soluzione (ioni). |
|
Le reazioni che avvengono sono:
riduzione (al catodo) Mn+ + n e- → M
Alcuni ioni metallici (Ag+, Cu++, etc.) possono depositarsi sul catodo.
In presenza di acidi, idrossidi, sali di metalli alcalini e alcalino-terrosi, può essere l'acqua a subire la riduzione:
2 H2O + 2 e- → H2 + 2 OH-
ossidazione (all'anodo) M → Mn+ + n e-
Questo tipo di reazione avviene se l'anodo è costituito da un metallo attaccabile (che possa perciò passare in soluzione sotto forma di ioni).
Se si tratta di alogenuri X (escluso però il fluoro F), in soluzione avviene la reazione:
2 X- → X2 + 2 e-
Se l'anodo è costituito da un metallo 'nobile' (come Pt, Au, etc.) e se non ci sono anioni che si possano scaricare facilmente, è l'acqua a subire l'ossidazione:
2 H2O → O2 + 4 H+ + 4 e-
Questo processo si chiama elettrolisi e può avvenire anche in assenza di solvente, per esempio nei sali fusi, purché esistano ioni in grado di muoversi (NaCl, HgCl2, KBr, NaOH, etc.).
Per esempio, per NaCl fuso (e in assenza di ossigeno e di acqua!) si hanno le seguenti reazioni:
al catodo: Na+ + e- → Na all'anodo 2 Cl- → Cl2 + 2 e-
L'elettrolisi di NaCl permette, con catodo di Hg, di ottenere Na metallico in amalgama, cosa impossibile in acqua, poiché si ridurrebbe H2O dando H2 anziché il metallo desiderato.
Ricordando che la carica elementare è 1,602 x 10-19 C (C = Coulomb, unità di misura elettrica) e che una mole contiene 6,022 x 1023 unità, per un metallo monovalente occorrerà una quantità di elettricità = 1 mole di elettroni = 96486,7 C
Approssimando, definiamo questa quantità di elettricità Faraday F
1 F = 96500 C
La stessa quantità basterà solo per 0,5 moli di metallo bivalente e così via.
Michael Faraday
|
Fig.27.3 Una fotografia di Michael Faraday Michael Faraday (Newington Butts 1791 - Hampton Court 1867), fisico e chimico britannico è noto per avere scoperto l'induzione elettromagnetica e le leggi dell'elettrolisi. Compì studi irregolari; nel 1812 frequentò un corso tenuto dal chimico Humphry Davy, del quale divenne poi assistente presso il laboratorio di chimica della Royal Institution. Le prime ricerche di Faraday si svolsero nel campo della chimica, sulle orme di Davy. Uno studio sul cloro condusse alla scoperta di due nuovi cloruri di carbonio e del benzene. Compì inoltre ricerche sulle proprietà ottiche del vetro e ottenne sperimentalmente la liquefazione di alcuni gas comuni. Le ricerche che fecero di Faraday il più insigne scienziato sperimentale dei suoi tempi ebbero come oggetto l'elettricità e il magnetismo. Nel 1821 riuscì a produrre un campo magnetico impiegando un conduttore attraversato da corrente elettrica. Nel 1831 fece seguire a questa scoperta quella dell'induzione elettromagnetica e, nello stesso anno, dimostrò l'interazione tra correnti elettriche. Nel frattempo studiò i fenomeni dell'elettrolisi e ne formulò le due leggi fondamentali. |
|
(da Enciclopedia Microsoft Encarta)
Le leggi stechiometriche di Faraday sulla elettrolisi sono del 1834
la quantità di elettrolita decomposto durante l'elettrolisi è proporzionale alla quantità totale di elettricità Q = i Δt in cui i è l'intensità di corrente, Δt è il tempo per cui essa circola.
la massa di ogni specie chimica trasformata ad ogni elettrodo per il passaggio di 1 F di elettricità è uguale al prodotto della massa molare, per il coefficiente di reazione, diviso il numero di elettroni scambiati (è perciò proporzionale alla massa equivalente).
Abbiamo visto così che l'energia elettrica può portare a trasformazioni chimiche; ma è possibile trasformare energia chimica in energia elettrica?
Possiamo far avvenire delle reazioni redox (di ossidoriduzione) in una apparecchiatura controllata, detta cella elettrochimica o pila.
Se mettiamo una lamina di zinco Zn in una soluzione di solfato di rame CuSO4 (che è di colore blu dovuto ad un complesso di Cu++ con l'acqua), Zn si ricopre progressivamente di polvere rossastra, mentre la soluzione scolora.
Avviene cioè la reazione: Zn + CuSO4 → Cu + ZnSO4
La polvere è Cu che si riduce (assorbendo elettroni dalla lamina di Zn); la soluzione scolora poiché diminuisce la concentrazione di ioni Cu++ (che, solvatato, è blu).
Contemporaneamente Zn deve ossidarsi a Zn++ e passa in soluzione (anche se questo processo non è visibile, dato che Zn++ è incolore.
In base a queste considerazioni, proviamo a costruire una 'pila' per sfruttare l'energia chimica del processo che, come si è visto, avviene spontaneamente; per far questo è necessario mantenere separati i due processi di ossidazione e riduzione.
|
Fig.27.4 Pila Daniell, che permette di ottenere energia elettrica da una reazione chimica di ossidoriduzione. Una lamina di Zn è immersa in una soluzione di Zn++ , una di Cu in una soluzione di Cu++. Le due lamine sono collegate mediante un circuito elettrico che comprende una resistenza R (per ridurre e controllare la velocità di passaggio degli elettroni e perciò del processo redox) e un amperometro A (per evidenziare l'intensità della corrente). Le due soluzioni sono collegate mediante il ponte salino P, costituito da un sifone contenente una soluzione di elettrolita inerte rispetto alla reazione (KCl, NH4Cl), supportata su agar-agar. Il ponte salino permette il riequilibrio elettrico delle soluzioni quando avviene la reazione redox; se non ci fosse, il circuito sarebbe bloccato e la reazione non potrebbe procedere. |
|
In questo modo, costruendo la pila, abbiamo praticamente separato la reazione
Zn + CuSO4 → Cu + ZnSO4
in due reazioni parziali:
all'anodo (osssidazione): Zn → Zn++ + 2 e-
al catodo (riduzione): Cu++ + 2 e- → Cu
ed abbiamo potuto così mettere in evidenza che avviene una trasformazione di energia chimica in energia elettrica; se le due reazioni fossero avvenute nella stessa soluzione avremmo avuto una meno evidente (e meno interessante) trasformazione di energia chimica in energia termica.
Ognuno dei due elementi che costituiscono la pila sono detti semielementi.
Praticamente tutte le reazioni redox spontanee possono generare energia elettrica.
Se invece di sfruttare le reazioni per ottenere energia elettrica, fornissimo noi l'energia elettrica, invertendo la direzione del flusso elettronico, potremmo far avvenire la reazione inversa. E' possibile perciò far avvenire anche reazioni non spontanee (elettrolisi).
Chiamiamo catodo l'elettrodo sul quale avviene la riduzione, anodo quello su cui avviene l'ossidazione (esattamente come nell'elettrolisi).
La fem generata (a circuito esterno interrotto, altrimenti non la potremmo misurare poiché cambierebbe continuamente) è una misura della tendenza della reazione ad avvenire ed è perciò collegabile, parlando in termini di termodinamica delle reazioni, al DG della trasformazione (come vedremo in seguito).
Se ΔG = 0 anche fem = 0 (perciò un sistema in equilibrio non può generare energia elettrica).
E' possibile costruire pile anche con metalli nobili, detti elettrodi inerti, immersi in soluzioni contenenti le forme ossidata e ridotta di una stessa specie chimica (Fe2+/Fe3+, Sn2+/Sn4+, Mn2+/MnO4-, etc.).
Altre pile si possono costruire utilizzando dei gas a contatto con elettrodi inerti; un esempio è l'elettrodo standard a idrogeno.
|
Fig.27.5 Elettrodo standard a idrogeno. Perché sia standard occorre che la pressione di H2 sia 1 atmosfera e che la concentrazione di H+ sia 1 molare. Può funzionare sia come anodo (ossidazione), sia come catodo (riduzione), a seconda del semielemento con cui viene accoppiato per costruire la pila. Il suo potenziale standard viene preso, per convenzione, come lo zero della scala dei potenziali ed è perciò un riferimento importante per definire la scala, benché esso sia piuttosto delicato da usare e sia difficile mantenerne le condizioni standard (se procede la reazione cambia infatti la concentrazione della soluzione). In effetti, anche se nella scala dei potenziali usata normalmente, i valori si considerano misurati rispetto a questo elettrodo in pratica se ne utilizzano altri, più semplici, stabili e riproducibili. |
|
Il potenziale di un elettrodo è misurato in volt e dipende dalle concentrazioni delle forme Ox (ossidata) e Red (ridotta), secondo la relazione di Nernst
|
Fig.27.6 Walther Hermann Nernst (1864-1941) Walther Hermann Nernst (Briesen 1864-Berlino 1941), fisico e chimico tedesco è noto soprattutto per la legge che fu poi generalizzata da Max Planck come terzo principio della termodinamica. Studiò alle università di Zurigo, Berlino, Graz e Würzburg. Dopo aver insegnato all'università di Gottinga, lavorò in quella di Berlino (1905) dove, in seguito, divenne direttore dell'Istituto di fisica sperimentale. Inventò una lampada a incandescenza, ancora oggi impiegata in laboratorio, ma il nucleo fondamentale della sua attività di ricerca fu lo studio degli equilibri chimici. Elaborò la teoria del potenziale elettrochimico e le leggi sulla conduzione di corrente elettrica nelle soluzioni. Nel 1920 ricevette il premio Nobel per la chimica. (da Enciclopedia Microsoft Encarta) |
|
Per una reazione generica
Ox + ne- → Red
la relazione di Nernst è la seguente
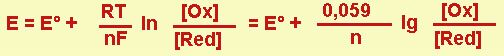
in cui: E è il potenziale dell'elettrodo ed E° il suo potenziale normale, cioè il potenziale dell'elettrodo in condizioni standard (concentrazione 1M per tutte le specie in soluzione, pressione 1 atm per i gas; T=25°C; metalli puri; sali poco solubili presenti come corpo di fondo); ed inoltre:
R = 8,313 (J mol-1 K-1);
F = 96500 (C);
T = 298,16 (K) (cioè 273.16 + 25);
n = numero di elettroni in gioco
Per convenzione si scrive così un potenziale di riduzione, in base alla reazione indicata sopra. Normalmente usiamo sempre gli E di riduzione.
Il potenziale di ossidazione (reazione inversa) sarebbe eguale, ma di segno opposto.
Gli E° sono tabulati e, se riferiti a reazioni in cui compaiono gli elementi con stato di ossidazione 0, la sequenza viene chiamata serie elettrochimica degli elementi.
|
Ox |
|
ne- |
|
|
Red |
E° |
|
Li+ |
|
e- |
|
|
Li |
|
|
K+ |
|
e- |
|
|
K |
|
|
Ba++ |
|
2e- |
|
|
Ba |
|
|
Ca++ |
|
2e- |
|
|
Ca |
|
|
Na+ |
|
e- |
|
|
Na |
|
|
Mg++ |
|
2e- |
|
|
Mg |
|
|
Be++ |
|
2e- |
|
|
Be |
|
|
Al+++ |
|
3e- |
|
|
Al |
|
|
Ti++ |
|
2e- |
|
|
Ti |
|
|
Mn++ |
|
2e- |
|
|
Mn |
|
|
V++ |
|
2e- |
|
|
V |
|
|
Zn++ |
|
2e- |
|
|
Zn |
|
|
Cr+++ |
|
3e- |
|
|
Cr |
|
|
Fe++ |
|
2e- |
|
|
Fe |
|
|
Cd++ |
|
2e- |
|
|
Cd |
|
|
Co++ |
|
2e- |
|
|
Co |
|
|
Ni++ |
|
2e- |
|
|
Ni |
|
|
Sn++ |
|
2e- |
|
|
Sn |
|
|
Pb++ |
|
2e- |
|
|
Pb |
|
|
2 H+ |
|
2e- |
|
|
H2 |
|
|
Cu++ |
|
2e- |
|
|
Cu |
|
|
O2 |
|
4e- |
+ 2 H2O |
|
4 OH- |
|
|
Cu+ |
|
e- |
|
|
Cu |
|
|
I2 |
|
2e- |
|
|
2 I- |
|
|
Hg++ |
|
2e- |
|
|
2 Hg |
|
|
Ag+ |
|
e- |
|
|
Ag |
|
|
Rh+++ |
|
3e- |
|
|
Rh |
|
|
Pd++ |
|
2e- |
|
|
Pd |
|
|
Br2 |
|
2e- |
|
|
2 Br- |
|
|
Cl2 |
|
2e- |
|
|
2 Cl- |
|
|
Au+++ |
|
3e- |
|
|
Au |
|
|
Au+ |
|
e- |
|
|
Au |
|
|
F2 |
|
2e- |
|
|
2 F- |
|
Fig.27.7 Serie elettrochimica degli elementi: comprende quasi tutti gli elementi più comuni nei loro stati di ossidazione più abituali. La freccia indicata non è doppia (benché le reazioni siano sempre possibili anche in senso contrario) poiché consideriamo sempre la reazione di riduzione.
Ma sono stati determinati gli E° per moltissimi altri sistemi redox, che non coinvolgono direttamente gli elementi allo stato di ossidazione 0. Nella tabella successiva ne vengono riportati alcuni.
|
Ox |
|
|
|
ne- |
|
Red |
|
|
E° |
|
2 SO3-- |
|
2 H2O |
|
2e- |
|
S2O4-- |
|
4 OH- |
|
|
SO4-- |
|
H2O |
|
2e- |
|
SO3-- |
|
2 OH- |
|
|
Cr+++ |
|
|
|
e- |
|
Cr++ |
|
|
|
|
2 SO4-- |
|
4 H+ |
|
2e- |
|
S2O6-- |
|
2 H2O |
|
|
CrO4-- |
|
4 H2O |
|
3e- |
|
Cr(OH)3 |
|
5 OH- |
|
|
S4O6-- |
|
|
|
2e- |
|
2 S2O3-- |
|
|
|
|
Sn++++ |
|
|
|
2e- |
|
Sn++ |
|
|
|
|
Cu++ |
|
|
|
e- |
|
Cu+ |
|
|
|
|
SO4-- |
|
4 H+ |
|
2e- |
|
H2SO3 |
|
H2O |
|
|
Fe(CN)6--- |
|
|
|
e- |
|
Fe(CN)6---- |
|
|
|
|
MnO4- |
|
|
|
e- |
|
MnO4-- |
|
|
|
|
MnO4-- |
|
2 H2O |
|
2e- |
|
MnO2 |
|
4 OH- |
|
|
O2 |
|
2 H+ |
|
2e- |
|
H2O2 |
|
|
|
|
Fe+++ |
|
|
|
e- |
|
Fe++ |
|
|
|
|
2 Hg++ |
|
|
|
2e- |
|
Hg2++ |
|
|
|
|
NO3- |
|
4 H+ |
|
3e- |
|
NO |
|
2 H2O |
|
|
MnO2 |
|
4 H+ |
|
2e- |
|
Mn++ |
|
2 H2O |
|
|
Tl+++ |
|
|
|
2e- |
|
Tl+ |
|
|
|
|
Cr2O7-- |
|
14 H+ |
|
6e- |
|
2 Cr+++ |
|
7 H2O |
|
|
MnO4- |
|
8 H+ |
|
5e- |
|
Mn++ |
|
4 H2O |
|
|
MnO4- |
|
4 H+ |
|
3e- |
|
MnO2 |
|
2 H2O |
|
|
Co+++ |
|
|
|
e- |
|
Co++ |
|
|
|
|
S2O8-- |
|
|
|
2e- |
|
2 SO4-- |
|
|
|
Fig.27.8 Scala dei potenziali normali per una serie di reazioni abbastanza comuni.
Mano a mano che aumenta E°, aumenta la capacità ossidante del sistema che, se in condizioni standard, potrà ossidare tutti i sistemi con E° inferiore, se in condizioni standard anch'essi.
Se il sistema, come succede quasi sempre, non è in condizioni standard, occorre calcolare il potenziale effettivo dei sistemi in gioco utilizzando la relazione di Nernst per sapere quale dei due elettrodi sia il più ossidante (cioè con potenziale più alto).
Dagli E° è possibile risalire alla K di equilibrio della reazione chimica totale che avviene nella pila.
Infatti, per la reazione generica
a A + b B D c C + d D
la variazione di energia libera per a moli di A che hanno reagito sarà

Per una pila reversibile (cioè con intensità di corrente erogata tendente a zero), il lavoro elettrico compiuto è
-ΔG che è uguale a E (in cui E è la differenza di potenziale, ddp) per la carica passata (cioè nF).
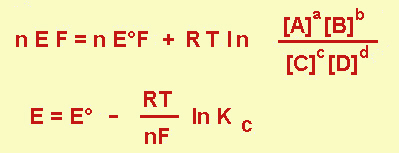
L'utilità dei metodi elettrochimici è enorme: permette, per esempio, di determinare il pH di una soluzione (si può perciò seguire una titolazione) misurando la fem di una pila formata da un elettrodo di riferimento e da un elettrodo sensibile alla concentrazione [H3O+].
Per far questo, invece dell'elettrodo a idrogeno, poco pratico, si preferisce usare l'elettrodo a vetro (detto anche 'a membrana').
Infatti, su una sottile membrana di certi vetri si crea una ddp se esso separa due soluzioni a diversa [H3O+].
|
|
|
Fig.27.9 Elettrodo a vetro. Il bulbo contiene un elettrodo di riferimento Ag/AgCl/Cl-. In figura la espressione ideale del potenziale della membrana di vetro. Il meccanismo non è chiaro, ma si suppone che i cationi delle cavità tetraedriche della silice (essendo il vetro costituito essenzialmente di SiO2, CaO, Na2O) si possano spostare verso altre cavità, se sottoposti a campo elettrico. |
Praticamente il sistema è formato da una soluzione a [H3O+] = costante (cioè tamponata) e di un elettrodo di riferimento interno (Ag/AgCl/Cl-); la E di quest'ultimo dipende da [Ag+], che è però condizionata dal prodotto di solubilità di AgCl, KPS AgCl.
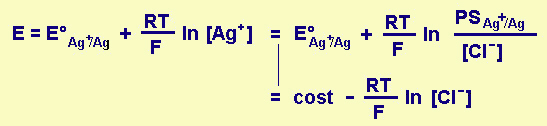
Fig.27.10 Potenziale o fem di un elettrodo di riferimento Ag/AgCl/Cl-
Altri elettrodi di riferimento possono essere quelli a calomelano di schema (Hg/Hg2Cl2(sat), KCl(xM)), il cui E dipende da [Cl-], che può essere , per esempio, O,1M, 1M o saturo di Cl- con KCl solido presente al fondo.
Stiamo parlando, da un po' di tempo, di 'misure di fem di una pila'; ma come si può determinare la fem di una pila?
Innanzitutto occorre operare in condizioni di reversibilità termodinamica, cioè senza passaggio di corrente (altrimenti variano le concentrazioni e, di conseguenza, gli E) e senza allontanarsi troppo dalle condizioni di equilibrio (ΔG=0), altrimenti la relazione di Nernst non è più valida.
Per la misura si usa uno strumento chiamato potenziometro.
|
Fig.27.11 Schema di potenziometro. La batteria B invia corrente attraverso il filo calibro AO (reocordo) e la resistenza variabile R. Si regola R finché si ha una certa ddp tra A e O. Quindi, dopo aver inserito il circuito scelto col deviatore D (la cella Weston di riferimento W, per la taratura, oppure la cella C da misurare) si regola il reostato col puntatore P in modo che il galvanometro non segni passaggio di corrente. Il galvanometro G, infatti, non ha la funzione di misurare l'intensità di corrente come un amperometro, bensì quella di individuare quando non passa corrente (la differenza sostanziale tra un amperometro e un galvanometro è che, mentre nell'amperometro lo zero è a fondo scala a sinistra, nel galvanometro è centrale; inoltre la sua sensibilità è elevatissima); la situazione in cui l'ago dell'indicatore punta sullo zero si chiama punto di azzeramento. |
|
Col potenziometro si bilancia la fem incognita con una fem nota, in modo che non passi corrente; il metodo è detto metodo di opposizione o di Poggendorf. Quando, variando la resistenza R e in base alla relazione V =R i, (differenza di potenziale V uguale al prodotto della resistenza R per l'intensità della corrente i) si è tarato il reocordo AO in modo da conoscere la ddp tra i due estremi A e O, il puntatore P del reostato individua in ogni momento una ddp proporzionale alla lunghezza del tratto AP, lunghezza che chiameremo lAP.
Operando con la cella incognita C si individua un tratto AP.
Tutte le operazioni debbono avvenire evitando al massimo qualsiasi passaggio di corrente, per non modificare le ddp delle celle.
Possiamo dire che Ecella = i RAP; cioè la ddp della cella è proporzionale a i e alla resistenza del tratto AP.
Ma poiché non conosciamo i, sarà necessario prendere come riferimento un'altra cella di ddp nota, come la cella Weston; con questa individueremo un tratto AW tale che EWeston = i RAW.
Tenendo presente che la resistenza di un filo calibro è proporzionale alla sua lunghezza l, potremo dire che:
RAP/RAW = lAP/lAW
Dividendo ora membro a membro, avremo che:
Ecella/EWeston = RAP/RAW = lAP/lAW
e da questa:
Ecella = EWeston lAP/lAW
|
|
|
Fig.27.12 Cella Weston 1 = soluzione satura di CdSO4 2 = cristalli di 3 CdSO4.8 H2O 3 = pasta di Hg2SO4 e Hg 4 = Hg 5 = amalgama 10-13% Cd/Hg La cella Weston è una cella standard, molto stabile anche se passa corrente, perfettamente reversibile e con un piccolissimo coefficiente di temperatura: ΔE/°C(4x10-5Volt/°C) EW = 1,01864 V |
Ricordiamo le convenzioni da seguire quando si parla di celle elettrolitiche (nelle quali si effettua una elettrolisi fornendo energia) o di celle galvaniche (nelle quali si sfrutta una reazione spontanea per ottenere energia).
|
|
Catodo |
Anodo |
||
|
|
segno |
reazione |
segno |
reazione |
|
cella elettrolitica |
|
riduzione |
|
ossidazione |
|
cella galvanica |
|
riduzione |
|
ossidazione |
Fig.27.13 Convenzioni per celle elettrolitiche e galvaniche
In una cella galvanica il catodo (+) è quello costituito dal sistema a potenziale più alto, perciò più ossidante; al catodo si avrà perciò riduzione: la sottrazione di elettroni dall'elettrodo lo rende positivo; all'anodo invece si avrà ossidazione: gli elettroni lasciati sull'elettrodo lo rendono negativo.
E' ovvio però che un semielemento potrà comportarsi da catodo o da anodo a seconda del semielemento che gli viene accoppiato.
Se abbiamo a disposizione per esempio i tre semielementi
(1) Cu++/Cu E° = +0,377
(2) Zn++/Zn E° = -0,763
(3) Ag+/Ag E° = +0,799
potremo ottenere 3 accoppiamenti diversi in cui un semielemento può assumere la funzione di anodo o di catodo in base al potenziale dell'altro semielemento:
|
|
|
Fig.27.14 Pile costituite mediante accoppiamenti di diversi semielementi. Per convenzione si mette a destra sempre quello con E più elevato, così che quando si fa la differenza (ddp) essa sia sempre positiva. |
Si nota che, mentre il semielemento Zn++/Zn, che possiede E° più basso, funziona, in questi esempi, sempre da anodo, il semielemento Cu++/Cu funge da catodo nel primo caso e da anodo nel terzo.
Se la differenza fosse negativa, occorrerebbe invertire le posizioni, in modo che sia sempre l'anodo a sinistra e il catodo a destra.
Sia nella cella elettrolitica sia nella galvanica, i cationi si muovono sempre dall'anodo verso il catodo, gli anioni viceversa, o per reagire sull'elettrodo o, quantomeno, per equilibrare la densità di cariche positive e negative nella soluzione.
Si possono costruire celle galvaniche anche con due semielementi che differiscono tra loro solo per la concentrazione della soluzione: sono dette pile a concentrazione.
(Notare anche la simbologia che si usa nel descrivere graficamente una pila: il simbolo / indica una interfaccia, generalmente metallo/soluzione; il simbolo // indica la separazione tra due soluzioni e corrisponde, praticamente, al ponte salino; tra parentesi la concentrazione dello ione nella soluzione).
Un esempio di pila a concentrazione può essere:
Zn / Zn++(0,001 M) // Zn++(1 M) / Zn
E = E2-E1 = E°Zn++/Zn + 00,59/2 lg [Zn++]2 - E°Zn++/Zn + 00,59/2 lg [Zn++]1
E = 00,59/2 lg [Zn++]2 / [Zn++]1 = 0,0295 lg 103 = 0,0885 V
La fem non dipende da E° né, perciò, dal sistema scelto, ma solo dal rapporto delle concentrazioni.
Le celle galvaniche sono utilizzate come sorgenti portatili di energia elettrica.
Ne vengono usati molti tipi, alcuni anche 'ricaricabili' (è possibile cioè, mediante una sorgente di energia esterna, provocare una elettrolisi che ristabilisce le condizioni iniziali).
Di questo tipo le più note sono le batterie al piombo.
Il nome 'batteria' dipende dal fatto che si tratta di più celle collegate in serie; in questo caso la cella eroga una ddp di 2V, perciò 6 celle in serie portano ad una ddp di 12V (le batterie comunemente usate nelle automobili erogano infatti 12 volt; in alcuni casi, quando serve una ddp di 24 volt, occorrerà avere 12 celle, oppure collegare in serie due batterie da 12 V).
L'anodo è costituito da elettrodi di Pb, sui quali avviene la reazione:
Pb(s) + SO4-- → PbSO4 (s) + 2 e-
Il catodo da elettrodi a PbO2:
PbO2 (s) + 4 H+ + SO4-- + 2 e- → PbSO4 (s) + 2 H2O
Nella reazione totale, che si ottiene sommando membro a membro le due precedenti (operativamente corrisponde all'utilizzo della energia elettrica erogata, perciò alla scarica progressiva della batteria), diminuisce la [H2SO4], perciò anche la densità del liquido; ciò permette di controllare facilmente lo stato di carica della batteria mediante un semplice picnometro (operazione che esegue l'elettrauto quando controlla lo stato di carica della batteria dell'auto). La reazione totale è:
Pb(s) + PbO2 (s) + 4 H+ + SO4-- → 2 PbSO4 (s) + 2 H2O
Il vantaggio di queste batterie (nonostante il peso elevato) è che sono ricaricabili, cioè reversibili, ed hanno una lunga durata: applicando una sorgente di energia esterna (dinamo o alternatore) in senso opposto, si può invertire la reazione, operando cioè una elettrolisi:
2 PbSO4 (s) + 2 H2O → Pb(s) + PbO2 (s) + 4 H+ + SO4-
In effetti è corretto, dato che la batteria è reversibile, scrivere la reazione totale, così:
Pb(s) + PbO2 (s) + 4 H+ + SO4-- D 2 PbSO4 (s) + 2 H2O
Altre celle usate comunemente, anche per la loro economicità, sono quelle dette pile a secco, anche se non sono veramente 'a secco', ma contengono l'elettrolita in un sistema gelatinoso.
La più comune è la pila zinco-carbonio
|
Fig.27.15 Sezione schematica di pila a secco zinco-carbonio 1 = parete di Zn (che funge da anodo); 2 = setto poroso; 3 = impasto di MnO2, NH4Cl, polvere di grafite; 4 = grafite (che funge da catodo); 5 = setto isolante La reazione all'anodo è: Zn (s) → Zn++ + 2e- Al catodo le reazioni sono molto complesse; una delle principali è: 2 MnO2 (s) + 2 NH4+ + 2 e- → Mn2O3 (s) + 2 NH3 + H2O Questa pila non è ricaricabile, ma è molto economica. |
|
La pila alcalina, che ha capacità maggiore ed eroga una ddp di 1.54 V, lavora in ambiente basico; le reazioni sono:
all'anodo Zn (s) + 2 OH- → ZnO (s) + H2O + 2e-
al catodo 2 MnO2 (s) + H2O + 2 e- → Mn2O3 (s) + 2 OH-
totale Zn (s) + 2 MnO2 (s) D ZnO (s) + Mn2O3 (s)
Un'altra pila è la pila nichel-cadmio, usata per calcolatori elettronici e piccoli apparecchi elettrici, che eroga una fem di 1.4 V e le cui reazioni sono:
all'anodo Cd (s) + 2 OH- → Cd(OH)2 (s) + 2e-
al catodo NiO2 (s) + 2 H2O + 2 e- → Ni(OH)2 (s) + 2 OH-
totale Cd (s) + NiO2 (s) + 2 H2O D Ni(OH)2 (s) + Cd(OH)2 (s)
Ci sono poi pile miniaturizzate di vario tipo, ma con una struttura fisica come quella schematizzata nella figura seguente:
|
Fig.27.16 Schema di pila a secco miniaturizzata (per orologi al quarzo, macchine fotografiche, etc.) 1 = anodo di Zn; 2 = guarnizione isolante; 3 = KOH (aq) concentrato assorbito su tamponi; 4 = separatore; 5 = granuli di HgO all'anodo Zn2 (s) + 2 OH- → ZnO (s) + H2O + 2e- al catodo HgO (s) + H2O + 2 e- → Hg (l) + 2 OH- totale Zn (s) + HgO (s) D ZnO (s) + Hg (l) |
|
Simile alla precedente è la pila a ossido d'argento, piuttosto costosa, le cui reazioni sono:
all'anodo Zn (s) + 2 OH- → Zn(OH)2 (s) + 2e-
al catodo Ag2O (s) + H2O + 2 e- → 2 Ag (s) + 2 OH-
totale Zn (s) + Ag2O (s) D Zn(OH)2 (s) + 2 Ag (s)
Il vantaggio, rispetto alla precedente, è che la fem è di 1,5 V esatti.
Si continua a progettare e a sperimentare nuovi tipi di pile a secco, perché la possibilità di poter disporre di sorgenti di energia elettrica trasportabili è diventata una delle esigenze maggiori del mondo attuale (basti pensare ai computer portatili, ai telefoni cellulari, alle telecamere, ecc.); gli obiettivi maggiori sono quelli di poter disporre di pile leggere, ad alte capacità e stabilità e possibilmente reversibili (alta durata).
 |
| Appunti su: |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |