 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3075 | Gradito: |
Leggi anche appunti:Sintesi di FeCl2(N,N'-C12H6N2O2)Sintesi di FeCl2(N,N'-C12H6N2O2) Come già ampiamente descritto nella parte Regole di risonanzaRegole di risonanza La posizione relativa degli atomi (connettività) I GasI Gas Materiale: 2 compresse effervescenti, un cilindro da 100 ml con |
 |
 |
Il processo di evaporazione interessa, come sappiamo, solo le molecole presenti sulla superficie del liquido. In una soluzione in cui siano disciolti alcuni soluti, nelle quantità molari n1, n2, n3,..nn, le molecole di ciascuno di essi sono distribuite in modo uniforme su tutta la massa della soluzione, e quindi anche sulla sua superficie, in modo proporzionale alla loro frazione molare (ni/ntot).
Ciascuna delle specie chimiche presenti in soluzione sarà soggetta ad un processo di evaporazione e contribuirà pertanto alla formazione di un vapore, costituito da una miscela di aeriformi. Ciascun componente la soluzione contribuirà alla tensione di vapore della soluzione in modo proporzionale alla frazione di molecole che occupano la superficie della soluzione ed alla sua maggiore o minore volatilità. In altre parole la tensione di vapore della soluzione dipenderà dalla frazione molare di ciascun componente la soluzione e dalla tensione di vapore del componente stesso.
La legge di Raoult esprime quantitativamente tale fenomeno, affermando
che la tensione di vapore (P) di una soluzione, a temperatura costante è
data dalla somma delle tensioni di vapore di ciascun componente la soluzione
allo stato puro (![]() ), moltiplicato
per la frazione molare (i) con cui il componente compare nella soluzione stessa.
), moltiplicato
per la frazione molare (i) con cui il componente compare nella soluzione stessa.
![]()
In altre parole, la tensione di vapore di una soluzione è una media ponderata delle tensioni di vapore dei suoi componenti, dove le frazioni molari rappresentano i fattori di ponderazione.
Ad esempio se misceliamo 5 moli di H2O, la cui tensione di vapore a 25°C è di 23,8 mm di Hg con 3 moli di alcool etilico, la cui tensione di vapore a 25°C è di 58,9 mm di Hg, la tensione di vapore della soluzione sarà
![]()
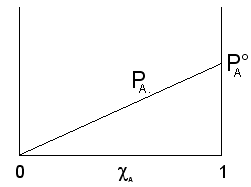
Possiamo rappresentare graficamente l'andamento della tensione di vapore nel caso di una soluzione a due componenti A e B, in funzione della loro frazione molare.
Il componente A, più volatile (![]() ), contribuisce alla tensione di vapore totale con una
tensione di vapore PA direttamente proporzionale alla sua frazione
molare ed alla tensione di vapore che manifesta allo stato puro
), contribuisce alla tensione di vapore totale con una
tensione di vapore PA direttamente proporzionale alla sua frazione
molare ed alla tensione di vapore che manifesta allo stato puro ![]() , secondo la
relazione
, secondo la
relazione
![]()
che rappresenta una retta di pendenza ![]() .
.
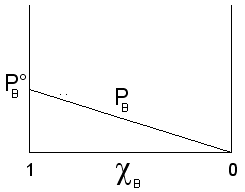
Il componente B, meno volatile (![]() ), contribuisce alla tensione di vapore totale con una
tensione di vapore PB direttamente proporzionale alla sua frazione
molare ed alla tensione di vapore che manifesta allo stato puro
), contribuisce alla tensione di vapore totale con una
tensione di vapore PB direttamente proporzionale alla sua frazione
molare ed alla tensione di vapore che manifesta allo stato puro ![]() , secondo la relazione
, secondo la relazione
![]()
che rappresenta una retta di pendenza ![]() .
.
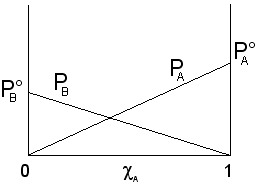
Tenendo conto che ![]() , l'equazione della retta diventa
, l'equazione della retta diventa ![]() che potremo
rappresentare sullo stesso grafico di A ottenendo
che potremo
rappresentare sullo stesso grafico di A ottenendo
L'andamento della tensione di vapore della soluzione per tutte le possibili combinazioni di A e B può quindi essere ottenuta, secondo quanto previsto dalla legge di Raoult, sommando punto a punto gli apporti dei due componenti (PA + PB). Si ottiene
![]()
e riordinando
![]()
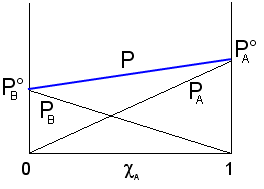
Dove si vede che il valore della tensione di vapore è sempre compreso
tra quello dei due componenti allo stato puro, variando linearmente tra questi
due estremi. La tensione di vapore totale è rappresentabile in un grafico che
porti la frazione molare del componente A in ascissa, come una retta di
pendenza ![]() e di
intersezione con l'asse delle ordinate
e di
intersezione con l'asse delle ordinate ![]() . Le soluzioni che rispettano la legge di Raoult si
dicono soluzioni ideali.
. Le soluzioni che rispettano la legge di Raoult si
dicono soluzioni ideali.
In moltissime soluzioni i soluti sono solidi che presentano tensioni di vapore talmente basse da poter essere trascurate. Nel caso più semplice di un unico soluto solido non volatile la legge di Raoult diventa
![]()
e, poiché possiamo porre ![]() = 0, si otterrà
= 0, si otterrà
![]()
da cui
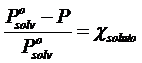
Tale relazione esprime il fatto che la presenza di molecole di soluto che non evaporano (o evaporano in modo trascurabile) alla superficie della soluzione, diminuiscono la superficie utile per l'evaporazione del solvente di una percentuale pari alla frazione molare del soluto e finiscono quindi per far diminuire la tensione di vapore del solvente della stessa percentuale.
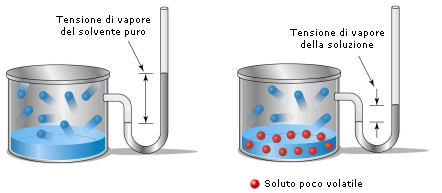
La legge di Raoult per
un soluto poco volatile
afferma infatti che l'abbassamento
relativo della tensione di vapore del solvente 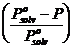 è uguale alla frazione molare del soluto
è uguale alla frazione molare del soluto![]() .
.
Se ad esempio sciogliamo 100 g di saccarosio (soluto poco volatile, PM = 342 g/mol) in 500 g di H20 a 26°C ( PM = 18 g/mol, P° = 25,2 mm di Hg), possiamo calcolare di quanto si abbassa la tensione di vapore del solvente, calcolando semplicemente la frazione molare del soluto
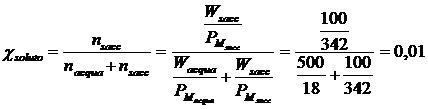
La tensione di vapore del solvente si abbassa dunque dell'1%, pari 25,2.0,01 = 0.25 mm di Hg e la tensione di vapore della soluzione sarà pari a
![]()
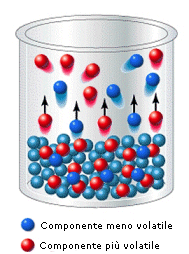
Si noti infine che, se due componenti una soluzione possiedono diversa volatilità (diverse tensioni di vapore), quello più volatile tenderà ad arricchire maggiormente il vapore e la sua frazione molare nella miscela gassosa risulterà, per la legge di Dalton, superiore alla sua frazione molare nella soluzione.
Se ad esempio mescoliamo, a 25°C, 15 moli di acqua (tensione di vapore 23,8 mm) con 15 moli di alcool etilico (tensione di vapore 58,9 mm), per la legge di Raoult la tensione di vapore della soluzione sarà pari a
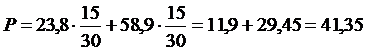
Si noti che la pressione parziale del vapor d'acqua nella miscela gassosa è di 11,9 mm di Hg, mentre la pressione parziale dell'alcool etilico gassoso è di 29,45 mm di Hg.
Per la legge di Dalton la frazione molare di un componente una miscela gassosa è esattamente pari al rapporto tra la sua pressione parziale e la pressione totale, per cui la frazione molare dell'alcool etilico nella miscela gassosa sarà pari a
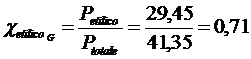
superiore alla frazione molare dell'etilico in soluzione ![]() . Il componente più volatile si trova dunque nel vapore
in percentuale maggiore rispetto a quanto non sia in soluzione.
. Il componente più volatile si trova dunque nel vapore
in percentuale maggiore rispetto a quanto non sia in soluzione.
Per distinguerla da quella dei componenti liquidi, la frazione molare dei componenti gassosi viene in genere indicata con la lettera Y.
Possiamo esprimere la frazione molare Y di un componente nella fase gassosa in funzione della frazione molare c che esso presenta nella soluzione. La frazione molare dei componenti nella fase gassosa vale
![]() e
e ![]()
ricordando che ![]() e che la tensione di vapore della soluzione vale
e che la tensione di vapore della soluzione vale ![]() otteniamo
otteniamo
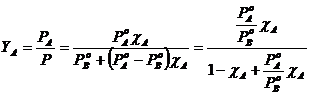
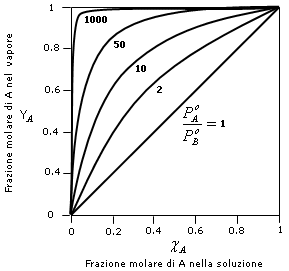
dove possiamo osservare che la frazione molare del componente più volatile A nella fase gassosa è tanto più elevata quanto maggiore è il rapporto tra la sua tensione di vapore e la tensione di vapore del componente meno volatile B.
Se i due componenti presentano la medesima tensione di vapore ![]() , allora la frazione molare in soluzione è uguale alla
frazione molare nella fase gassosa
, allora la frazione molare in soluzione è uguale alla
frazione molare nella fase gassosa ![]() .
.
Nel grafico successivo è riportato l'andamento della curva 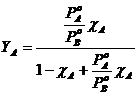 per diversi
valori del rapporto
per diversi
valori del rapporto ![]()
Possiamo infine esprimere la tensione di vapore della soluzione in funzione della frazione molare YA del componente più volatile nella fase gassosa.
Ricordando che la frazione molare YA del componente più volatile nella fase gassosa è pari a
![]()
esplicitiamo la frazione molare cA del componente nella soluzione
![]()
e sostituiamone il valore nella tensione di vapore della soluzione ![]() . Otteniamo
. Otteniamo
![]() o
o 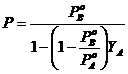
dove possiamo osservare che la tensione di vapore non varia linearmente con la frazione molare YA del componente nella fase gassosa.
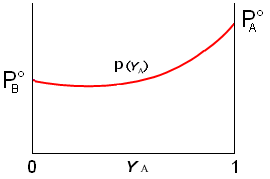
Se riportiamo in un unico grafico l'andamento della pressione di vapore (a T costante) in funzione della frazione molare sia in fase gassosa (YA) che in fase acquosa (cA), otteniamo un diagramma in cui è possibile osservare come il vapore sia più ricco nel componente più volatile (YA > cA
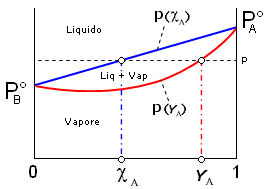
Questa circostanza permette normalmente di separare i due componenti una soluzione per distillazione. Il vapore che si ottiene facendo bollire una soluzione è infatti più ricco nell'elemento più volatile. Se i vapori così ottenuti vengono poi fatti condensare, la nuova soluzione che se ne ottiene risulta anch'essa più concentrata nell'elemento più volatile. Eseguendo più volte il processo è possibile separare completamente i due componenti.
 |
| Appunti su: legge raoult appunti, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |