 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1792 | Gradito: |
Leggi anche appunti:NomenclaturaNomenclatura Tabella con i primi 100 elementi chimici (Z = numero atomico Composizione chimica del SilicioComposizione chimica del Silicio Elemento chimico del IV gruppo del sistema periodico, Stabilità degli addotti N,N'-coordinati in N-metil-pirrolidoneStabilità degli addotti N,N'-coordinati in N-metil-pirrolidone 1.1.1. CoCl2(N,N'-C12H6N2O2) In |
 |
 |
Il legame chimico
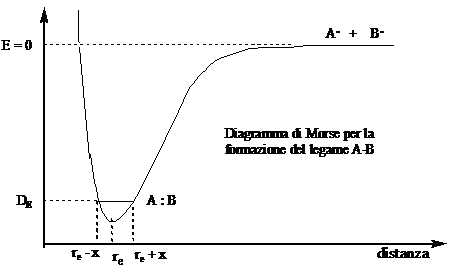
Consideriamo un sistema formato da due atomi, ciascuno contenente un elettrone spaiati. Quando la loro distanza è virtualmente infinita l'energia del sistema è data dalla somma delle energie dei due atomi separati (E = 0). Quando gli orbitali atomici entrano in contatto l'energia diminuisce, fino a raggiungere un minimo, dopodiché aumenta rapidamente tendendo all'infinito. La distanza alla quale l'energia è minima (re) è chiamata lunghezza di legame. L'energia che bisogna fornire al sistema per separare nuovamente gli atomi è chiamata energia di legame (DE) [Nota che l'energia di legame non corrisponde al valore minimo dell'energia, poiché gli atomi non stanno fermi alla distanza di legame re, ma vibrano attorno ad essa tra (re + x) e (re - x). La differenza di energia tra DE e il minimo è chiamata energia di vibrazione
Esistono due modelli per razionalizzare la formazione del legame tra due atomi: il modello del legame di valenza e il modello degli orbitali molecolari secondo il metodo LCAO-MO. Il primo è molto semplice, ed è il modello al quale si fa generalmente riferimento. Tuttavia il legame di valenza non riesce a descrivere vari fenomeni, tra cui il comportamento radicalico della molecola di ossigeno, la formazione degli spettri elettronici UV-visibile, e il meccanismo delle reazioni pericliche (cicloaddizioni, reazioni elettrocicliche, trasposizioni sigmatropiche), descrivibili invece con i modello degli orbitali molecolari. E' molto diffusa in chimica organica la prassi di descrivere lo scheletro della molecola, formato da legami s, tramite il modello del legame di valenza, e il sistema di legami p tramite gli orbitali molecolari. Il modello LCAO-MO verrà descritto in appendice.
Il Modello del Legame di Valenza (VB)
Quando gli atomi raggiungono la distanza di legame sovrappongono gli orbitali contenenti gli elettroni spaiati per formare un nuovo orbitale, centrato tra i due nuclei, nel quale si dispongono i due elettroni. La sovrapposizione è tanto migliore quanto più simili sono le dimensioni degli orbitali. La spinta alla formazione del legame deriva dal fatto che, una volta messi in compartecipazione, gli elettroni sono indistinguibili; formalmente entrambi gli elettroni appartengono a entrambi gli atomi. Questo consente agli atomi di colmare le lacune elettroniche e di raggiungere la configurazione del gas nobile (regola dell'ottetto).
Il legame è espresso dalle 3 forme in risonanza di Lewis, riassunte da un trattino:
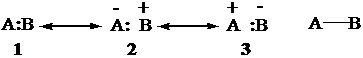
Il legame A-B è un ibrido di risonanza
delle tre strutture limite (strutture canoniche) 1-3.
Legame covalente Se gli atomi A e B hanno la stessa elettronegatività, le strutture 1, 2 e 3 hanno lo stesso peso: gli elettroni (nuvola elettronica) è centrata tra i due nuclei.
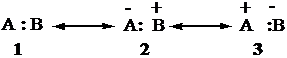
Legame covalente polare Se l'atomo A è più elettronegativo di B, la struttura 3 ha un peso trascurabile, poiché gli elettroni non avranno nessuna tendenza a stare più su B che non su A. Il legame è espresso dalle forme in risonanza 1 e 2.
La nuvola elettronica è spostata verso l'atomo A, che viene ad assumere una parziale carica negativa, mentre sull'atomo B si crea una parziale carica positiva.
Il legame covalente polare si rappresenta con la notazione
![]()
Legame ionico Se la differenza di elettronegatività tra A e B è molto grande (es., metalli alcalini e alogeni), anche la forma in risonanza 1 ha un peso trascurabile. Gli elettroni sono localizzati sull'atomo A. Si formano due ioni, uno positivo, l'altro negativo. Il legame ionico è rappresentato dalla notazione
![]()
Legami s e legami p
La migliore sovrapposizione tra gli orbitali atomici si ha quando l'asse degli orbitali atomici coincide con la direzione di avvicinamento dei due atomi. In questo caso il nuovo orbitale, localizzato tra i due nuclei, ha una simmetria cilindrica e il legame viene definito legame s
La sovrapposizione di due orbitali s origina sempre un legame s. Un legame s si origina anche per sovrapposizione tra un orbitale s e uno p, o tra due orbitali p.

La sovrapposizione di due orbitali p perpendicolari alla direzione di avvicinamento dei due atomi origina un orbitale localizzato sopra e sotto l'asse del nuovo legame. Il legame viene definito p. Gli elettroni del legame p, rispetto a quelli del legame s, risentono meno dell'attrazione dei nuclei. Sono quindi più mobili (polarizzabili). Il legame p risulta più debole del legame s
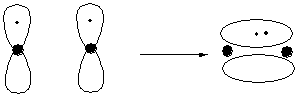
La sovrapposizione tra due orbitali p perpendicolari tra loro è nulla.
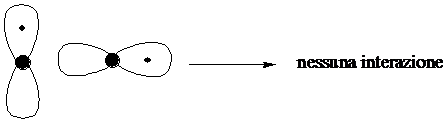
Elettroni di valenza Elettroni del guscio esterno che un atomo può utilizzare per formare legami
Valenza E' un concetto ambiguo, che si presta a più definizione. Si può intendere come il numero di elettroni che un atomo impiega per formare legami, ovvero come il numero di legami che un atomo può formare.
Numero di coordinazione Indica il numero di atomi che sono legati a un determinato atomo.
Energie di legame
|
Tipo di legame |
Kcal/mol |
Tipo di legame |
Kcal/mol |
|
Legami C-C sp3-sp3 |
75-90 |
Legame C-F |
85-125 |
|
Legami C-C sp2-sp3 |
ca. 100 |
Legame C-Cl |
72-85 |
|
Doppio legame CC |
ca. 170 |
Legame C-Br |
60-70 |
|
Triplo legame CC |
ca 230 |
Legame C-I |
48-57 |
|
Legame C(sp3)-H |
85-105 |
Legame C-O |
90-110 |
|
Legame C(sp2)-H |
ca 105 |
Legame O-O |
38-51 |
|
Legame C(sp)-H |
ca 130 |
Legame O-H |
80-120 |
|
Legame C-N |
85-102 |
Legame a idrogeno |
ca. 5 |
Coordinazione dei principali elementi
1° Gruppo (Li, Na) Configurazione s1.
Numero di coordinazione 1. Si legano a un solo legante L, formando un legame ionico o fortemente polare.
Li-L, Na-L
2° Gruppo (Be, Mg) Stato fondamentale s2 p0 configurazione eccitata s1p1
Numero di coordinazione 2 (lineare). Ibridizzazione s1p1 2 (sp)1: formazione di 2 legami s con due leganti L. I legami formano un angolo di 180°
L-Be-L, L-Mg-L
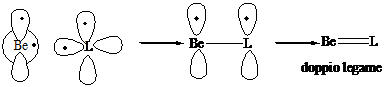
Numero di coordinazione 1. Formazione di un
legame s e di un legame p col legante L (doppio
legame)
3° Gruppo (B, Al) Stato fondamentale s2p1 configurazione eccitata s1px1 py1 pz0.
Numero di coordinazione 3 (planare). Ibridizzazione s1px1 py1 pz0 3(sp2)1 pz0 : formazione di tre legami s con tre leganti L. I legami giacciono su un piano distanziati di 120°.
Numero di coordinazione 4 (tetraedrica). L'orbitale pz0 può essere utilizzato per formare un nuovo legame s con un legante che ha un orbitale contenente un doppietto di elettroni. All'atto della formazione del nuovo legame si ha una reibridizzazione 3(sp2)1 pz0 3(sp3)1 1(sp3)0. Gli orbitali sp3 sono diretti verso i vertici di un tetraedro, distanziati tra loro di 109°.
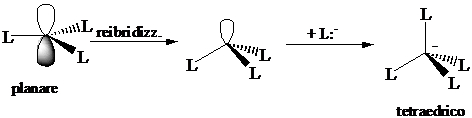
4° Gruppo (C) Stato fondamentale s2px1py1 pz0 configurazione eccitata s1px1 py1 pz1
Numero di coordinazione 4 (tetraedrica) Ibridizzazione s1px1 py1 pz1 4(sp3)1: formazione di 4 legami s con 4 leganti L
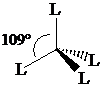
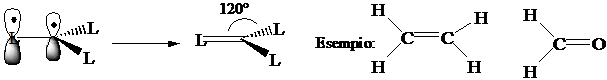
Numero di coordinazione 3 (planare) Ibridizzazione s1px1
py1 pz1 3(sp2)1 pz1:
formazione di 3 legami s con 3 leganti L e
di un legame p con uno dei 3
leganti
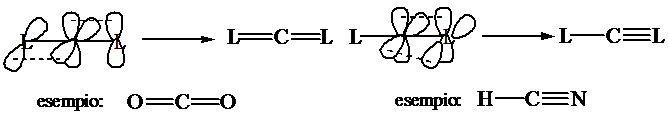
Numero di coordinazione 2 (lineare)
Ibridizzazione s1px1 py1
pz1 2(sp)1 py1pz1:
formazione di 2 legami s con 2 leganti L;
formazione di un legame p con ciascuno dei due
leganti L (due doppi legami) o di due legami p con uno dei due leganti L.
5° Gruppo (N) Configurazione s2px1py1 pz1
Numero di coordinazione 3 (tetraedrica) Ibridizzazione s2px1 py1 pz1 3(sp3)1(sp3)2 : formazione di 3 legami s con 3 leganti L. Rimane un doppietto di non legame sul quarto orbitale sp3.
Numero di coordinazione 4 (tetraedrica) Utilizzo del doppietto di non legame per formare un quarto legame s

6° Gruppo (O) Configurazione s2px2py1 pz1
Numero di coordinazione 2 (tetraedrica) Ibridizzazione s2px2 py1 pz1 2(sp3)1 2(sp3)2: formazione di 2 legami s con 2 leganti L. Rimangono due doppietti di non legame.
Numero di coordinazione 3 (tetraedrica) Può utilizzare un doppietto di non legame per formare un nuovo legame s
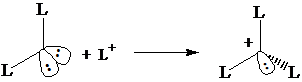
7° Gruppo (F) Configurazione s2px2py2 pz1
Numero di coordinazione 1 (tetraedrica) Ibridizzazione s2px2 py1 pz1 2(sp3)1 2(sp3)2 formazione di 1 legami s con 1 legante L. Rimangono tre doppietti di non legame.
NOTA: gli atomi più pesanti del 6° gruppo e 7° gruppo (S, Cl, Br, I), potendo utilizzare anche gli orbitali d a bassa energia, possono avere coordinazione superiore a quella di O e F.
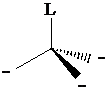
 |
| Appunti su: |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |