 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2707 | Gradito: |
Leggi anche appunti:Il quarto stato della materia: il plasmaIL QUARTO STATO DELLA MATERIA: IL PLASMA L'esperienza quotidiana La corrosioneLA CORROSIONE PROTEZIONE DELL'ARMATURA DOVUTA ALL'ALCALINITA' DEL CALCESTRUZZO. La teoria quantistica e la struttura atomicaLa teoria quantistica e la struttura atomica 1 L'energia di prima ionizzazione |
 |
 |
In tal caso, dopo che il sale si è dissociato in acqua, sia il catione che l'anione prodotti tendono a riformare, naturalmente in misura diversa, la base debole e l'acido debole da cui provengono. Il pH della soluzione sarà naturalmente acido se kb < ka, mentre sarà basico in caso contrario.
Prendiamo ad esempio il cianuro di ammonio NH4CN, che deriva dall'idrossido di ammonio NH4OH (base debole, kb = 1,8.10-5) e dall'acido cianidrico HCN (acido debole, ka = 4,9.10-10).
Per calcolare il pH di tale soluzione sarebbe necessario tener conto simultaneamente dei seguenti tre equilibri
H2O ![]() H+ + OH-
H+ + OH-
2) NH4OH ![]() NH4+ + OH-
NH4+ + OH-
HCN ![]() H+ + CN-
H+ + CN-
Poiché la costante di dissociazione dell'acido cianidrico è inferiore di quella dell'ammoniaca acquosa (ka < kb) possiamo prevedere che l'acido cianidrico si riassoci in percentuale maggiore rispetto all'idrossido di ammonio (il 3° equilibrio risulta cioè più spostato verso sinistra rispetto al 2°). La soluzione sarà pertanto basica.
La soluzione esatta del problema richiederebbe naturalmente la risoluzione di un sistema di equazioni in cui compaiano tutte le condizioni relative ai tre equilibri.
|
Soluzione esatta Nei tre equilibri compaiono le seguenti 6 incognite. 1) [H+] 2) [OH-] 3) [HCN] 4) [CN-] 5) [NH4OH] 6) [NH4+] Dobbiamo pertanto scrivere 6 equazioni indipendenti nelle 6 incognite. Le prime tre equazione si ricavano dalle equazioni di equilibrio rispettivamente dell'acido, della base e dell'acqua
la quarta si ottiene dal bilancio delle cariche (la somma di tutte le cariche positive deve essere uguale alla somma di tutte le cariche negative)
la quinta e la sesta si ricavano infine dal bilancio di massa per l'acido e per la base. Ricordando che il sale è completamente dissociato in C mol/L di cianuro CN- e C mol/L di ammonio NH4+, dopo l'idrolisi la somma delle due specie (dissociata ed indissociata) all'equilibrio dovrà essere pari alla concentrazione iniziale C e potremo quindi scrivere
utilizzando le 6 equazioni ed effettuando le opportune sostituzioni si ottiene
con x = [H+] un'equazione di quarto grado che ci permette di calcolare il valore esatto della concentrazione totale di ioni H+ per una soluzione di un sale formato da un acido debole ed una base debole. |
La risoluzione approssimata prende invece in considerazione il seguente equilibrio di idrolisi
NH4+ + CN- + H2O ![]() NH4OH + HCN
NH4OH + HCN
C - x C - x x x
secondo il quale per ogni ione OH- che si riassocia con uno ione NH4+, uno ione H+ si riassocia con uno ione CN-.
Si può facilmente dimostrare che la costante di tale equilibrio vale

Tenendo presente che le concentrazioni iniziali di NH4+ e di CN- sono pari alla concentrazione C del sale completamente dissociato, sarà quindi possibile calcolare le concentrazioni di equilibrio delle quattro specie chimiche.

Come si può osservare si ottengono delle concentrazioni uguali per le specie dissociate (x = [NH4+] = [CN-]) e per le specie indissociate ( C - x = [NH4OH] = [HCN]) e quindi risulteranno uguali anche i loro rapporti
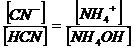
se dunque dalla relazione di equilibrio della base esplicitiamo il rapporto tra le specie dissociata e quella indissociata
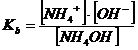 →
→ 
e lo sostituiamo nella relazione di equilibrio dell'acido, otteniamo
![]()
ricordando infine che [OH-] = kw/[H+], sostituendo otteniamo
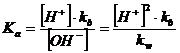
e quindi
 mol/L
mol/L
che corrisponde ad un pH = 9.28 (basico).
Si noti come la concentrazione degli ioni [H+], e quindi anche il pH, risulti indipendente (almeno nell'approssimazione che stiamo considerando) dalla concentrazione C del sale.
Si noti anche che il rapporto kw/kb è pari alla ka dell'acido coniugato (NH4+) della base (NH4OH) e quindi la formula semplificata per il calcolo del pH di una soluzione contenente un sale formato da un acido debole ed una base debole può anche essere scritta
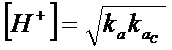
con
ka = kappa acida dell'acido debole
kac = kappa acida dell'acido coniugato della base debole
Si tenga infine presente che se il sale è molto diluito (C ≤ 10-4 M) la formula semplificata non fornisce un risultato soddisfacente e la concentrazione degli ioni H+ risente della concentrazione del sale. In tal caso è conveniente calcolare il pH trascurando l'idrolisi dello ione che presenta la costante di idrolisi più piccola ed utilizzando per l'idrolisi dell'altro ione le formule trovate per il calcolo del pH di acidi (o basi) deboli monoprotici (a seconda del valore di C e kh).
Esempio
Calcoliamo la concentrazione di ioni H+ di una soluzione 10-2 M di ipoclorito di ammonio NH4ClO (HClO ka = 3 10-8 - NH3 kb = 1,8 10-5) e di una soluzione 10-6 M del medesimo sale.
Sono presenti i seguenti equilibri di idrolisi
1) idrolisi acida NH4+ + H2O ![]() NH4OH + H+
NH4OH + H+ ![]()
idrolisi basica ClO- + H2O ![]() HClO + OH-
HClO + OH- ![]()
Essendo la costante di idrolisi basica più
elevata della costante di idrolisia acida (![]() ), la soluzione risulterà basica. Se applichiamo la
formula approssimata otteniamo il
medesimo valore di [H+] sia
per la soluzione 10-2 M che
per la soluzione 10-6 M.
), la soluzione risulterà basica. Se applichiamo la
formula approssimata otteniamo il
medesimo valore di [H+] sia
per la soluzione 10-2 M che
per la soluzione 10-6 M.
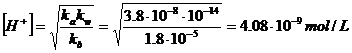
Se applichiamo l'equazione di quarto grado che ci fornisce il risultato esatto troviamo:
per la soluzione 10-2 M una concentrazione idrogenionica [H+] = 4,09 10-9 mol/L
per la soluzione 10-6 M una concentrazione idrogenionica [H+] = 2,30 10-8 mol/L
Come si può osservare la soluzione 10-6 M presenta una concentrazione degli ioni H+ inferiore di circa un ordine di grandezza rispetto alla soluzione 10-2 M.
Trascuriamo allora l'equilibrio di idrolisi acida, la cui costante di equilibrio è di circa 3 ordini di grandezza inferiore rispetto all'equilibrio di idrolisi basica.
Applichiamo ora all'equilibrio di idrolisi basica una delle quattro formule risolutive semplificate per il calcolo del pH di acidi e basi deboli monoprotici.
Verifichiamo quali condizioni di applicabilità sono soddisfatte
Poiché C·kh(B) = 10-6 x 3,3 10-7 = 3,3 10-13 < 10-12 non possiamo utilizzare la relazione
![]()
Poiché kh(B) = 3,3 10-7 > 10-7 non possiamo utilizzare la relazione
![]()
Poiché C = 10-6 > 10-7 non possiamo utilizzare la relazione
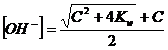
utilizziamo dunque l'ultima relazione

e dunque
![]()
 |
| Appunti su: |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |