 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 6238 | Gradito: |
Leggi anche appunti:Redox con più di due elementi che variano il noxRedox con più di due elementi che variano il nox In reazioni redox complesse LA GHISA - Produzione della ghisa, Tipi particolari di ghisa, Destinazione e impiego della ghisaLA GHISA La ghisa comune contiene una percentuale di carbonio che varia dal Relazione - verifica sperimentale della legge di Gay-LussacRelazione Oggetto: verifica sperimentale della legge di Gay-Lussac Disegno: Esperienza: Per |
 |
 |
I cationi dei metalli (in modo particolare i metalli di transizione) formano in soluzione degli ioni idratati (composti di coordinazione) che si comportano come acidi. Le soluzioni di tali sali sono tutte più o meno acide ed il processo che avviene è analogo a quello descritto per l'idrolisi acida. In tal caso però il valore della costante di idrolisi viene espresso come ka dello ione idratato (acquoione).
Ad esempio le soluzioni di cloruro ferrico FeCl3 sono molto acide. Potremmo descrivere il fenomeno dicendo che mentre lo ione cloruro Cl- non si riassocia per dare l'acido cloridrico forte, lo ione ferrico Fe3+ da luogo al seguente equilibrio di idrolisi
Fe3+ + H2O ![]() FeOH2+ + H+
FeOH2+ + H+
Tale reazione viene però comunemente indicata come dissociazione acida dello ione ferrico e la costante di reazione è nota come ka e non come kh.
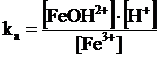
In realtà la reazione reale non coinvolge lo ione ferrico, ma lo ione idratato (ione esaacquoferro(III)) e questo vale per la maggior parte dei cationi metallici con proprietà acide.
Fe(H2O)63+ ![]() [Fe(OH)(H2O)5]2+ + H+
[Fe(OH)(H2O)5]2+ + H+
Lo ione complesso esaacquoferrico si comporta come un acido dissociandosi in uno ione H+ e in uno ione complesso pentaacquo-idrosso-ferrico, responsabile quest'ultimo della comune colorazione verde-giallastro delle soluzioni dei sali ferrici (lo ione esaacquoferrico ha una colorazione porpora chiaro).
I due equilibri precedenti sono comunque equivalenti.
Esempio
Calcoliamo la concentrazione di ioni H+ in una soluzione 10-3 M di FeCl3 (ka = 6,3 10-3) ed in una soluzione 10-7 M del medesimo sale.
Fe3+ + H2O ![]() FeOH2+ + H+
FeOH2+ + H+
Trattiamo l'equilibrio di idrolisi acida come un normale equilibrio di dissociazione di un acido debole ed individuiamo la formula semplificata da applicare alla soluzione 10-3 M.
Poiché C/ka = 10-3 / 6.3 10-3 = 0.16 < 102 e C = 10-3 > 10-7 utilizziamo la relazione
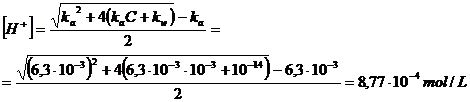
Individuiamo ora la formula semplificata da applicare alla soluzione 10-7 M. Poiché C = 10-7 ≤ 10-7 e ka = 6,3 10-3 >10-7 utilizziamo la relazione
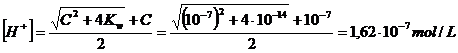
* * * * * * * * * *
Le molecole d'acqua coordinate ai cationi metallici hanno proprietà acide più spiccate delle molecole d'acqua libere di muoversi nella soluzione. Il fenomeno è da porre in relazione con l'indebolimento del legame O-H delle molecole coordinate a seguito dello spostamento della nube elettronica verso l'ossigeno, a sua volta causato dalla presenza dell'interazione tra i doppietti elettronici dell'ossigeno e la carica positiva dello ione metallico.
Più forte è l'interazione e più è acido il catione metallico.
L'intensità dell'interazione dipende principalmente, dalla carica del catione (Z) dal raggio ionico (r) e dall'elettronegatività dell'elemento considerato.
Si osserva che all'aumentare della carica e al diminuire del raggio ionico l'acidità aumenta.
Per cationi con elettronegatività (secondo Pauling) inferiore a 1,5 si trova una proporzionalità diretta tra il valore del pka ed il rapporto Z2/r. Se il raggio ionico viene espresso in picometri si ha
pka = 15.14 - 88.16(Z2/r)
Inoltre, a parità di Z2/r, i cationi con elettronegatività superiore a 1,5 sono in genere più acidi. Per essi vale la relazione
pKa = 15.14 - 88.16[(Z2/r) + 0. 096(cp
con cp = Elettronegatività secondo Pauling
In altre parole la coordinazione modifica le proprietà acido-base dell'acqua.
Il legante H2O (pka = 14.0) coordinato agli ioni Ca2+ o Zn2+ modifica il suo valore di pka a 12.8 e 9.5, rispettivamente:
[Zn(H2O)6]2+ + H2O ⇄ [Zn(H2O)5(OH)]+ + H3O+ ka = 3.3 10-10
Questo effetto è del tutto generale e, oltre all'acqua quale legante, vale per molti altri leganti (tioli, fenoli, alcoli, acido fosforico e acidi carbossilici).
La carica positiva del catione metallico stabilizza infatti la base coniugata di acidi protici attraverso la coordinazione al centro metallico.
Ad esempio l'acido acetico in acqua ha pKa = 4.7, ma in presenza dello ione Ni2+ (0.1 M) il pka diventa 4.0 e se lo ione è Cu2+ il pka diventa 3.0.
La coordinazione dello ione acetato al centro metallico sposta l'equilibrio di dissociazione dell'acido a destra e l'acido acetico diventa un acido più forte.
I cationi metallici possono essere classificati in gruppi a seconda del valore di Z2/r.
|
Relazione tra il rapporto Z2/r e l'acidità dei cationi metallici |
||||
|
Z2/r |
χp |
Acidità |
Intervallo di pKa |
Esempi |
|
< 0.01 |
<1.5 |
Non acidi |
|
Maggior parte dei cationi alcalini |
|
< 0.01 |
>1.5 |
Acidi debolissimi |
|
Tl+ |
|
|
<1.5 |
Maggior parte dei cationi alcalino-terrosi |
||
|
|
>1.5 |
Acidi deboli |
|
Maggior parte dei cationi 2+ del blocco "d" |
|
|
<1.5 |
Tutti i cationi 3+ del blocco "f" |
||
|
|
>1.5 |
Acidi moderati |
|
Maggior parte dei cationi 3+ del blocco "d" |
|
|
<1.5 |
Maggior parte dei cationi 4+ del blocco "f" |
||
|
|
>1.5 |
Acidi forti |
1 |
Maggior parte dei cationi 4+ del blocco"d" |
|
|
<1.5 |
|
||
|
> 0.16 |
>1.5 |
Acidi fortissimi |
< - 4 |
|
|
> 0.22 |
<1.5 |
|
||
In relazione alla diversa acidità del catione metallico, l'idrolisi può proseguire oltre la formazione dell'idrosso-catione, attraverso una serie di tappe caratteristiche che portano alla formazione di un idrossido (in genere insolubile) e, se il metallo è molto acido, di un idrosso-anione ed infine un osso-anione.
Ad esempio per l'Alluminio si può avere la seguente progressione
Al3+ + 6H2O Al(H2O)63+
Catione metallico catione idratato (acquo-ione)
Al(H2O)63+ + H2O ⇄ Al(H2O)5(OH)2+ H3O+ ka = 1,4 10-5
Acquo-ione Idrosso-catione
Al(H2O)5(OH)2+ ⇄ Al(H2O)(OH)3 2H3O+
Idrosso-catione Idrossido (idratato)
3) Al(H2O)(OH)3 + H2O ⇄ Al(OH)4 H3O+
Idrossido Idrosso-anione
4) Al(OH)4 + 4H2O ⇄ AlO45 + 4H3O+
Idrosso-anione Ossoanione
In generale, la forma con cui un catione metallico è presente in soluzione dipende dunque dalla sua acidità, ma è comunque possibile spostare gli equilibri tramite variazioni di pH.
Un catione moderatamente acido come l'alluminio (pka = 4,85) non è in grado di completare la sequenza, ma è ovviamente possibile spostare gli equilibri verso destra aggiungendo ioni OH- (aumentando il pH) che rimuovono gli ioni H3O+ (formando acqua) o verso sinistra aggiungendo ioni H+ (diminuendo il pH).
I cationi, con un rapporto carica-raggio molto grande Z2/r >> 0.22, non esistono in soluzione acquosa come tali, nemmeno a pH fortemente acido. Sono presenti invece i loro osso-anioni.
Il catione Al3+ inizia a precipitare come idrossido quando il pH > 5, raggiunge un minimo di solubilità per pH = 7 e si ridiscioglie come idrosso-anione e osso-anione per pH > 12.
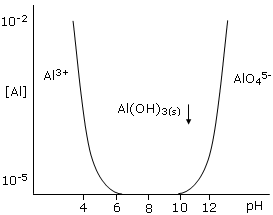
Si tratta di un comportamento caratteristico degli idrossidi anfoteri insolubili, i quali ridiventano solubili sia quando si abbassa il pH, comportandosi come basi, che quando si alza il pH, comportandosi come acidi.
Al(OH)3(s) 3H3O+ ⇄ Al(H2O)63+ (comportamento basico)
Idrossido insolubile catione-idratato solubile
Al(OH)3(s) OH- ⇄ Al(OH)4 (comportamento acido)
Idrossido insolubile Idrosso-anione solubile
 |
| Appunti su: esaacquoferro, 0, idrolisi metalli, https:wwwappuntimaniacomscientifichechimicaidrolisi-acida-di-un-catione-m53php, aciditC3A0 dei cationi metallici, |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |