 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1529 | Gradito: |
Leggi anche appunti:Isotropia 4° dimensione e curvatura dello spaziotempoIsotropia 4° dimensione e curvatura dello spaziotempo Nel capitolo 2.2 ho parlato I numeri quanticiI numeri quantici I numeri quantici sono così chiamati poiché definiscono Nomenclatura chimicaNomenclatura chimica Valenza: Termine obsoleto per indicare il numero di |
 |
 |
GLI ACIDI E LE BASI
ACIDI E BASI NELLA VITA QUOTIDIANA
GLI ACIDI
Sono caratterizzati da un sapore aspro:
aceto T acido acetico (CH3COOH)
succo di limone T acido citrico
yogurt T acido lattico
acido cloridrico (HCl), acido nitrico (HNO3), acido solforico (H2SO4) T impieghi industriali
Nel nostro organismo sono presenti degli acidi. Per esempio nello stomaco viene secreto acido cloridrico (HCl), responsabile dell''acidità di stomaco'
Sostanze di natura acida sono anche gli ossidi di zolfo e di azoto, che si originano nella combustione dei combustibili fossili (centrali termoelettriche e autoveicoli). Questi ossidi si diffondono nell'atmosfera, reagiscono con l'ossigeno e con l'acqua, e ricadono al suolo con le precipitazioni atmosferiche, sotto forma di soluzioni diluite di acido solforico (H2SO4) e acido nitrico (HNO3)
piogge acide, che sono pericolose per le colture e per i monumenti
Determinano il cambiamento di colore di alcune sostanze T quando si aggiunge del succo di limone al tè, questo diventa più chiaro
Fanno diventare rossa una cartina al tornasole
è un indicatore, cioè una sostanza che in soluzione acida assume una colorazione, in soluzione basica ne assume un altro
Reagiscono con alcuni metalli, sviluppando idrogeno
Zn(s) + H2SO4(aq) T ZnSO4(aq) + H2(g)
LE BASI
Sono caratterizzati da un sapore amaro:
cucchiaino di bicarbonato di sodio disciolto in un bicchiere di acqua
idrossido di ammonio (ammoniaca)
ipoclorito di sodio (candeggina)
idrossido di sodio o soda caustica (NaOH)
carbonato di sodio (soda)
idrossido di potassio (KOH)
Nel nostro organismo sono presenti degli acidi. Per esempio il sangue è leggermente basico
Determinano il cambiamento di colore di alcune sostanze T se si aggiunge dell'ammoniaca al tè, questo diventa più scuro
Fanno diventare blu una cartina al tornasole
Al tatto sono viscide
Mescolando quantità opportune di un acido e di una base si ottiene una miscela che non ha più né caratteristiche acide né caratteristiche basiche T reazione di neutralizzazione
acido + base T sale + acqua
LA DISSOCIAZIONE ELETTROLITICA (Arrhenius)
Il primo tentativo di interpretare chimicamente il comportamento degli acidi e delle basi spetta a Arrhenius, che:
non conosceva la struttura dell'atomo
intuì che alcune sostanze erano conduttori di corrente e altre no
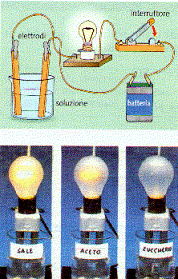 in relazione alla
conducibilità elettrica, le sostanze in soluzione acquosa possono
essere distinte in:
in relazione alla
conducibilità elettrica, le sostanze in soluzione acquosa possono
essere distinte in:
buoni conduttori T cloruro di sodio (NaCl)
cattivi conduttori T acido acetico (C2H4O)
non conduttori T zucchero
Secondo Arrhenius, le sostanze che conducono la corrente elettrica sono quelle che, disciolte nell'acqua, si scindono in ioni
veicoli della corrente sono gli ioni
v negativi T catodo T cationi
v positivi T anodo T anioni
si chiamano elettroliti: una soluzione è tanto più conduttrice quanto maggiore è il numero degli ioni di elettrolita che in essa sono presenti
Gli elettroliti a loro volta sono distinti in elettroliti:
ionici T sostanze che allo stato solido ci sono già dei reticoli cristallini (NaCl). Quando gli elettroliti ionici sono posti in acqua:
gli ioni positivi attraggono le estremità negative delle molecole dell'acqua
gli ioni negativi attraggono le estremità positive delle molecole dell'acqua
l'acqua non fa altro che idratare (dissociazione elettrolitica)
Na+Cl-(s) T Na+(aq) + Cl-(aq)
Na+OH-(s) T Na+(aq) + OH-(aq)
ione idrossido
covalenti T sostanze che allo stato puro sono composti molecolari, che non contengono ioni; essi formano ioni solo quando entrano in contatto con l'acqua (reazione di ionizzazione)
HCl(g) + H2O(l) T H3O+(aq) + Cl-(aq) dal cloruro di idrogeno si è formato acido cloridrico
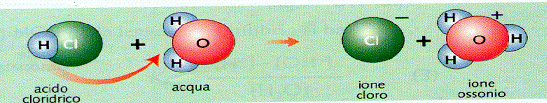
ossonio, risultato dalla
'cattura' da parte della molecole dell'acqua dello ione H+
C'è poi un'ulteriore differenziazione, tra elettroliti:
forti T in soluzione acquosa si dissociano del tutto (reazioni irreversibili). La conducibilità delle soluzioni è elevata. Esempi: NaCl, HCl, H2SO4
deboli T in soluzione acquosa si dissociano solo parzialmente (reazione in equilibrio). La conducibilità è molto più bassa. Esempi sono l'acido acetico e l'ammoniaca
CH3COOH(l) + H2O H+(aq) + CH3COO-(aq)
NH3 + H2O NH4+(aq) + OH-(aq) T ione ammonio
In base ai risultati delle osservazioni sulla dissociazione elettrolitica, Arrhenius definì:
acidi le sostanze che in soluzione acquosa si dissociano, liberando uno o più ioni idrogeno, o protoni
basi le soluzioni che in soluzione acquosa si dissociano, liberando uno o più ioni idrossido, OH-
Esempi di acidi forti: Esempi di basi forti:
H2SO4 T acido solforico KOH T idrossido di potassio
HNO3 T acido nitrico Ca(OH)2 T diidrossido di calcio
ACIDI E BASI SECONDO LA TEORIA DI BRÖNSTED-LOWRY
La definizione di acido e di base proposta da Arrhenius escludeva da questa categorie sostanze come CO2 e NH3.
NH3, che non contiene gruppi OH- e quindi non può liberarli, si comporta come una base
CO2, che non contiene atomi di idrogeno e quindi non può liberarli, si comporta come un acido
Per includere questi tipi di sostanze, si ipotizzò che le loro proprietà acide o basiche dipendessero dalle loro reazioni con il solvente acqua
NH3(g) + H2O(l) T NH4+(aq) (ione ammonio) + OH-(aq)
CO2(g) + H2O(l) T H2CO3 (acido carbonico) T H+(aq) + HCO3-(aq)
Nel 1923 Brönsted e Lowry contemporaneamente, ma separatamente, dettero una definizione nuova ad acido e base, senza legarla al tipo di solvente:
acido T sostanza che cede ioni idrogeno H+ (protoni), o meglio H3O (H+ è molto piccolo, e quindi instabile)
base T sostanza che accetta ioni idrogeno H+ (protoni)
NH3 + H2O NH4+ + OH-
base acido acido base
![]() NH4+
è l'acido coniugato di NH3
NH4+
è l'acido coniugato di NH3
OH- è la base coniugata di H2O gli acidi contengono al loro interno la base coniugata
L'acido è forte quando ha una grande tendenza a cedere l'ossonio H3O alla base
La base è forte quando ha una grande tendenza ad accettare l'ossonio H3O dall'acido
A un acido forte corrisponde una base coniugata debole
A una base forte corrisponde un acido coniugato debole
Si può scrivere la costante di equilibrio keq, che:
nel caso di un acido, si chiama costante di acidità ka
nel caso di una base, si chiama costante di basicità kb
[NH4+] [OH-] NH3 è una base debole
![]() Kb = T
Kb = T
[NH3] [H2O] l'equilibrio è spostato verso sinistra (kb > 1)
NH3 + H2O NH4+ + OH-
[Na+] [OH-] NaOH è una base forte
![]() Kb = T
Kb = T
[NaOH] [H2O] l'equilibrio è spostato verso destra (kb < 1)
NaOH + H2O Na+ + OH-
[H+] [CH3COO-] CH3COOH è una acido debole
![]() Ka = T
Ka = T
[NaOH] [H2O] l'equilibrio è spostato verso sinistra (ka > 1)
CH3COOH + H2O H+ + CH3COO-
[H3O+] [Cl-] HCl è una acido forte
![]() Ka = T
Ka = T
[HCl] [H2O] l'equilibrio è spostato verso destra (ka < 1)
HCl + H2O Cl- + H3O+
Nota la ka di un acido si può ricavare la kb della base coniugata e viceversa, in base alla relazione:
Ka Kb = kw = 10-14
L'ACQUA PURA: UN ELETTROLITA DEBOLE
La reazione di dissociazione dell'acqua, che porta alla formazione di ioni idrogeno H+ e ioni idrossido OH- è una reazione di equilibrio, che si scrive correttamente così
H2O(l) + H2O(l) H3O+(aq) + OH-(aq)
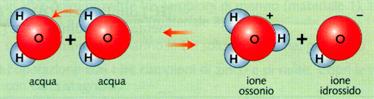
Anche se spesso si preferisce usare la notazione semplificata:
H2O(l) H+(aq) + OH-(aq)
L'acqua è un elettrolita molto debole; ciò significa che si dissocia poco in ioni. Quindi la forma indissociata viene considerata una costante, che corrisponde alla costante di equilibrio keq:
[H3O] [OH-]
![]()
![]() Keq = T Keq [H2O]2
= [H3O] [OH-]
Keq = T Keq [H2O]2
= [H3O] [OH-]
[H2O]2
Kw = [H3O] [OH-] = (1.8
prodotto ionico dell'acqua
Nella reazione di ionizzazione dell'acqua per ogni ione H+ si forma sempre uno ione OH-, quindi nell'acqua pura le concentrazioni di H+ e di OH- devono essere sempre uguali
[H+] = [OH-]
H+ = 10-7
OH- = 10-7
LA SCALA DEL pH
In base alla variazione della concentrazione di H3O+ e OH- si può stabilire se la soluzione è acida o basica:
se sono uguali T soluzione neutra
se è maggiore la concentrazione di H3O+ T soluzione acida
se è maggiore la concentrazione di OH- T soluzione basica
l'acidità e la basicità si misurano utilizzando il pH
logaritmo negativo di base 10 della concentrazione dello ione idrogeno (pH = -log [H+])
cambio di segno il valore della concentrazione degli ioni H3O+
ha valori che vanno dallo O al 14
pH = 7 T soluzione neutra T H3O+ = OH-
pH < 7 T soluzione acida T più basso è il valore del pH e più acida è la soluzione
pH > 7 T soluzione basica T più alto è il valore del pH e più basica è la soluzione
GLI INDICATORI
Si possono usare due metodi:
indicatori T una sostanza che in soluzione acida assume una colorazione, in soluzione basica ne assume un altro (cartina al tornasole)
piccametro T si immerge una sonda costituita da un elettrodo a vetro direttamente nella soluzione e si legge su una apposita scala il valore del pH
 |
| Appunti su: |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |