 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1813 | Gradito: |
Leggi anche appunti:Il Meccanismo delle Reazioni OrganicheNei casi più semplici, le reazioni possono avvenire in un unico stadio o in due Equilibrio di complessazione e pHEquilibrio di complessazione e pH Analogamente a quanto accade per gli equilibri Elementi chimici (massa, configurazione elettronica, nox, etimo)Elementi chimici (massa, configurazione elettronica, nox, etimo) Ordinati per |
 |
 |
La dipendenza dell'entropia dalla Temperatura si esprime tramite la seguente relazione
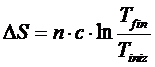
dove
n = numero di moli
c = capacità termica molare
Nel caso di una reazione chimica di cui si conoscano le entropie standard delle specie chimiche si avrà

dove ΔC è la somma delle capacità termiche dei prodotti meno la somma delle capacità termiche dei reagenti (a volume o a pressione costante a seconda dei casi)
Esempio
Data la reazione di dissociazione dell'ipoazotide N2O4(g) = 2NO2(g) ed utilizzando i dati della tabella seguente riferiti a 25°C, determinare il grado di dissociazione dell'ipoazotide a 25°C e a 100°C, alla pressione di 1,5 atm
|
|
ΔHf° (kJ mol-1) |
S° (J K-1 mol-1) |
cp (J K-1 mol-1) |
|
N2O4 |
|
|
|
|
NO2 |
|
|
|
L'entalpia di reazione a 25°C è ΔHr° = 2·33,18 - 9,16 = 57,20 kJ
L'entropia di reazione a 25°C è ΔSr° = 2·240,06 - 304,29 = 175,83 J K-1
L'energia libera di reazione a 25°C è ΔGr° = ΔHr° - T ΔSr° = 57,20 - 298,15 ·0,17583 = 4,78 kJ
Calcoliamo ora la costante di equilibrio a 25°C
![]()
Indichiamo ora con n il numero iniziale di moli di ipoazotide e con a il suo grado di dissociazione. All'equilibrio avremo
numero di moli di ipoazotide N2O4 dissociate = na
numero di moli di ipoazotide N2O4 indissociate = n-na = n(1-a
numero di moli di biossido NO2 generate = 2na
numero di moli totali = n-na + 2na = n + na = n(1+a
Le frazioni molari delle due specie chimiche saranno pertanto

![]()
e le loro pressioni parziali all'equilibrio
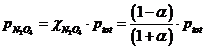
![]()
Scriviamo ora la relazione di equilibrio

dalla quale, esplicitando a, si ottiene

Stimiamo ora l'entalpia di reazione a 100°C calcolando inizialmente la differenza tra le capacità termiche delle specie chimiche
ΔCp = 2·37,20 - 77,28 = -2,88 J K-1
Ed ora usiamo l'equazione di Kirchhoff per stimare l'entalpia
ΔHr = ΔHr° + ΔCp· ΔT = 57,20 + (-0,00288)·(373,15-298,15) = 57,00 kJ
Stimiamo ora l'entropia di reazione a 100°C
![]()
Stimiamo l'energia libera di reazione a 100°C
ΔGr = ΔHr - T ΔSr = 57,00 - 373,15 ·0,17518 = -8,37 kJ
Calcoliamo ora la costante di equilibrio a 100°C
![]()
e stimiamo infine il grado di dissociazione dell'ipoazotide a 100°C
dalla quale, esplicitando a, si ottiene
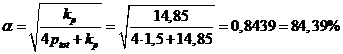
 |
| Appunti su: |
|
| Appunti Ingegneria tecnico |  |
| Tesine Geografia |  |
| Lezioni Biologia |  |