 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2351 | Gradito: |
Leggi anche appunti:La moleLA MOLE 1. LA LEGGE DI GAY-LUSSAC O DEI VOLUMI DI COMBINAZIONE · Gay-Lussac Reazioni di ossidoriduzioneReazioni di ossidoriduzione Ossidazione - Un elemento chimico si ossida quando, Il Processo DryIl Processo Dry Il primo processo di realizzazione della doppia giunzione |
 |
 |
Dieni ePolieni
Idrocarburi contenenti due o più doppi legami CC

Preparazione degli alcheni

1) Cracking catalitico di idrocarburi
Metodo industriale per la preparazione degli alcheni più semplici (etilene, propilene, butadiene)
2) Disidratazione di alcoli in ambiente acido
![]()
3) Deidroalogenazione di alogenoderivati in ambiente basico
![]()
4) Reazione di Wittig

Reazioni degli alcheni
1) Reazioni di addizione elettrofila via Carbocatione.
Reazioni a due stadi. 1° Stadio (lento): addizione del protone al sistema p del doppio legame CC con formazione di un carbocation. 2° Stadio (veloce): attacco della specie nucleofila al carbocatione. V = k [Alchene][H+]. Reazione non stereoselettiva (l'attacco può avvenire indifferentemente su entrambe le facce del carbocatione planare). L'addizione su alcheni non simmetrici è regioselettiva. La posizione di attacco è governata dalla formazione del carbocatione più stabile (benzile>allile>terziario>secondario>primario).
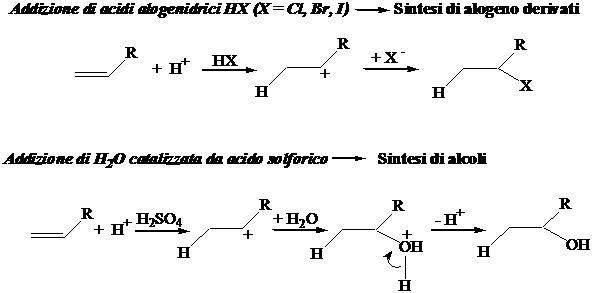

Regola di Markovnikov: l'addizione del protone avviene sempre sull'atomo di carbonio che contiene più idrogeni.

Vladimir Vasilevich Markovnikov
(Nizhny Novgorod, 1838 - 1904)
La reazione di trasposizione dei carbocationi (Trasposizioni di Wagner-Merrwein)
La regiochimica della reazione elettrofila è complicata da una reazione parassita che interessa i carbocationi, comunque generati: la reazione di trasposizione. Atomi di idrogeno o gruppi alchilici possono migrare verso il carbocatione portandosi dietro il doppietto di elettroni di legame, qualora la migrazione porti alla formazione di un carbocatione più stabile.
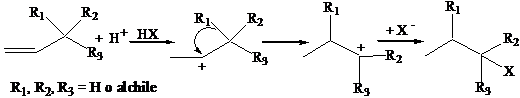
2) Reazione di trans-addizione elettrofila via ione alonio
Reazione di addizione elettrofila trans-stereoselettiva a due stadi di alogeno molecolare. 1° Stadio (lento): formazione di un catione ciclico a 3 termini (ione alonio) e di uno ione alogenuro. 2° Stadio: attacco stereoselettivo da parte dello ione bromuro su un atomo di carbonio dello ione ciclico. L'attacco avviene dalla parte opposta rispetto a quella dell'atomo di alogeno già presente.

3) Reazione di cis-addizione elettrofila di borano
Reazione di addizione elettrofila cis-stereoselettiva ad uno stadio. La specie elettrofila è l'atomo di boro. Mentre si sta formando il legame C-Br si ha concomitante migrazione di un atomo di idrogeno legato al boro verso l'incipiente carbocatione. B e H si addizionano dalla sessa parte: addizione cis-stereoselettiva. La regiochimica è governata dalla regola di Markovnikov. L'idrolisi ossidativa conduce alla formazione di alcoli primari.
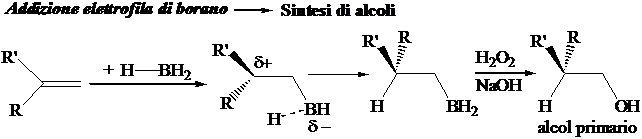
4) Reazioni sincrone di cis-addizione.


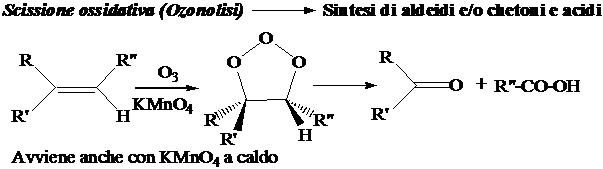
5) Reazioni di addizione radicalica


 |
|


|
|

 |
| Appunti su: |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |