 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 4367 | Gradito: |
Leggi anche appunti:Isomeria costituzionaleIsomeria costituzionale La diversa connettività degli isomeri di struttura Velocità di reazioneVelocità di reazione Viene definita cinetica chimica quella branca della Interazioni tra atomiInterazioni tra atomi Le interazioni tra gli atomi si dividono in 2 tipi: |
 |
 |
I metalli di transizione, che allo stato elementare possiedono livelli d o f parzialmente occupati, formano una vasta classe di composti, detti complessi o composti di coordinazione. in cui il metallo centrale M (allo stato neutro o ionizzato) forma legami covalenti dativi (o di coordinazione) con una serie di atomi o gruppi chimici, detti leganti (o ligandi, italianizzando il termine inglese 'ligands'), neutri o di carica opposta rispetto all'atomo centrale. Il metallo centrale agisce come acido di Lewis (accettore di elettroni, elettrofilo) nei confronti dei leganti che si comportano come basi di Lewis (donatori di doppietti elettronici, nucleofili).
Un complesso può risultare neutro od elettricamente carico (ione complesso); ovviamente la sua carica sarà data dalla somma delle cariche del metallo centrale e dei leganti. La formula di un complesso viene racchiusa tra parentesi quadre, scrivendo prima il metallo centrale e poi i leganti. Negli esempi seguenti indichiamo con M il metallo centrale e con L i leganti
catione complesso [Co(NH3)6]3+ (M = Co3+, L = 6 NH3)
anione complesso [PtCl4]2 - (M = Pt4+, L = 6 Cl-)
complesso neutro [Fe3 (CO)12] (M = 3 Fe, L = 12 CO)
complesso neutro [Cr(H2O)3Cl3] (M = Cr3+, L = 3 H2O, L = 3 Cl-)
Nel nome del complesso vengono invece indicati per prima i leganti e per ultimo il metallo (atomo centrale), secondo le seguenti regole.
[NiCl4]2- tetracloronichelato(II)
[Ni(PPh3)4] tetrakis(trifenilfosfina)nichel(0)
[Co(en)3]3+ tris(etilendiammina)cobalto(III)
|
Leganti anionici |
Leganti neutri |
||
|
F- |
Fluoro |
H2O |
Acquo |
|
Cl- |
Cloro |
NH3 |
Ammino |
|
Br- |
Bromo |
CO |
Carbonil |
|
I- |
Iodo |
NO |
Nitrosil |
|
H- |
Idrogeno (Idruro) |
N2 |
diazoto |
|
:CN- |
Ciano |
O2 |
diossigeno |
|
OH- |
Idrosso |
en |
etilendiamina |
|
CO32- |
Carbonato |
dien |
dietilentriamina |
|
C2O42- (Ox) |
Ossalato |
trien |
trietilentetraamina |
|
:SCN- |
Tiocianato |
py |
piridina |
|
:NCS- |
Isotiocianato |
bpy (bipy) |
bipiridina |
|
O2- |
Osso (Oxo) |
terpy |
terpiridina |
|
O22- |
Perosso |
PH3 |
fosfina |
|
O2- |
Superosso |
PPh3 |
trifenilfosfina |
|
EDTA4- |
etilendiamminotetraacetato |
PMe3 |
trimetilfosfina |
|
acac- |
acetilacetonato |
PEt3 |
trietilfosfina |
|
CH3- (Me) |
metil |
PF3 |
trifluorofosfina |
|
CH3CH2- (Et) |
etil |
NH2Me |
metilamina |
|
NO2- |
nitrito |
difos |
difosfano |
|
SO32- |
solfito |
diars |
diarsano |
|
Ph- |
fenil |
glime |
glicodimetiletere |
|
CH3COO- (MeCOO-) |
acetato (etanoato) |
|
urea |
|
gly- |
glicinato |
C2H4 |
etene |
|
sal- |
salicilato |
CH3CN |
acetonitrile |
|
C5H5- |
ciclopentadienil |
|
|
|
N3- |
azido (azoturo) |
|
|
|
N3- |
nitruro |
|
|
NH3 = ammino NH2 = amina (o ammina)
|
1 mono |
11 undeca |
21 henicosa |
31 hentriaconta |
50 pentaconta |
600 esacta |
|
2 di (bis) |
12 dodeca |
22 docosa |
32 dotriaconta |
60 hexaconta |
700 eptacta |
|
3 tri (tris) |
13 trideca |
23 tricosa |
33 tritriaconta |
70 heptaconta |
800 octacta |
|
4 tetra (tetrakis) |
14 tetradeca |
24 tetracosa |
34 tetratriaconta |
80 octaconta |
900 nonacta |
|
5 penta (pentakis) |
15 pentadeca |
25 pentacosa |
35 pentatriaconta |
90 nonaconta |
1000 kilia |
|
6 esa (esakis) |
16 esadeca |
26 esacosa |
36 esatriaconta |
100 ecta |
2000 dilia |
|
7 epta (eptakis) |
17 eptadeca |
27 eptacosa |
37 eptatriaconta |
200 dicta |
3000 trilia |
|
8 octa (octakis) |
18 octadeca |
28 octacosa |
38 octatriaconta |
300 tricta |
4000 tetrilia |
|
9 nona (nonakis) |
19 nonadeca |
29 nonacosa |
39 nonatriaconta |
400 tetracta |
5000 pentilia |
|
10 deca (decakis) |
20 icosa |
30 triaconta |
40 tetraconta |
500 pentacta |
10000 miria |
(octa=otta, epta=etta)
I complessi in cui il metallo centrale lega un solo tipo di leganti sono detti omolettici ( ad esempio esaamminocobalto(III) [Co(NH3)6]3+), quelli in cui il metallo si lega a gruppi diversi (ad esempio tetraamminodiclorocobalto(III) [Co(NH3)4Cl2]+) sono detti eterolettici.
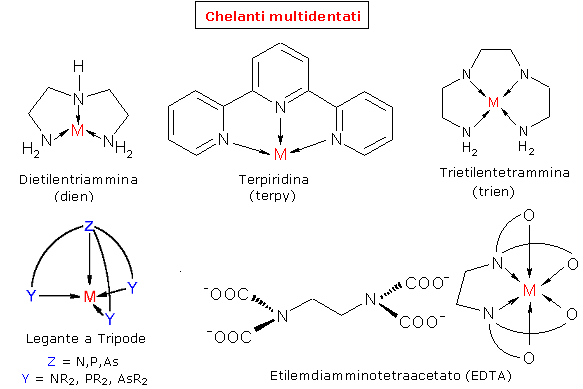
I leganti vengono classificati in relazione al numero di doppietti elettronici (e quindi di legami) che possono utilizzare per legarsi all'atomo centrale. Se un legante forma un solo legame con l'atomo centrale il legante si dice monodentato (CO, NH3, CN-, OH-, H2O etc), se ne forma due si dice bidentato (dien, en, acac.) e così via. I leganti polidentati si definiscono agenti chelanti ed i complessi che presentano leganti polidentati si definiscono anche composti chelati.
Un complesso chelato risulta più stabile di un analogo complesso contenente solo leganti monodentati. Tale aumento di stabilità è noto come effetto chelato.
Ad esempio [Ni(en)3]2+ che contiene tre anelli chelati è quasi 1010 volte più stabile di [Ni(NH3)6]2+ che contiene solo leganti monodentati
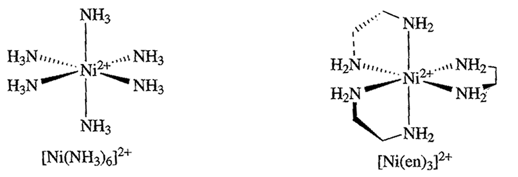
La stabilizzazione dovuta all'effetto chelato è fortemente dipendente dalle dimensioni dell'anello chelante, Gli anelli a 5 membri, come nei complessi metallici dell'en (en = 1,2-diamminoetano), sono spesso i più stabili, perché presentano la minor tensione (strain) di anello.
Un caso particolare di chelazione si verifica con leganti macrociclici, leganti polidentati nei quali più atomi donatori formano un ampio anello. all'interno del quale viene sequestrato il metallo. Un esempio classico è l'anello porfirinico nell'emoglobina e nella clorofilla.
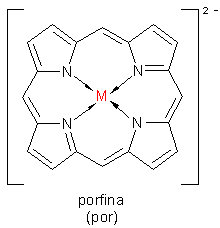
Un'importante classe di chelanti macrociclici sono gli eteri a corona
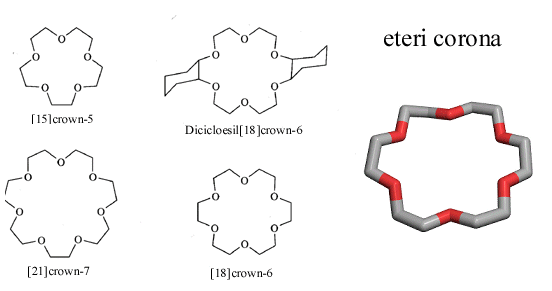
Il primo numero nel nome dell'etere indica il numero di atomi dell'anello (in genere racchiuso in parentesi quadre), mentre il secondo numero indica il numero di atomi di ossigeno (o di altri donatori). I chelanti macrociclici simili agli eteri a corona sono chiamati coronanti (o coronandi o corandi, italianizzando i termini inglesi 'coronands' e 'corands'). I relativi complessi sono detti coronati (o coronaplex o coraplex).
Come un legante polidentato produce un complesso più stabile di quello prodotto da n leganti monodentati di tipo simile, così un legante macrociclico n-dentato produce complessi più stabili del più simile legante n-dentato a catena aperta (effetto macrociclico).
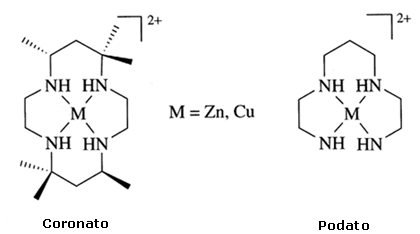
Si definiscono podanti (o podandi, italianizzando il termine inglese 'podands') gli analoghi aciclici dei coronanti. I relativi complessi sono detti podati (o podaplex)
L'effetto macrociclico rende i coronanti fino a 104 volte più stabili rispetto ai relativi podanti, specie acicliche strettamente correlate con lo stesso tipo e numero di siti donatori. Nell'esempio mostrato nell'immagine successiva, entrambi i complessi godono della stabilizzazione associata ai quatto legami, tuttavia la prima specie più stabile dell'analogo aciclico (a destra) proprio per effetto macrociclico.
priorità CIP a>b>c>d
a=1 b=2 c=3 d=4
I chelanti macrobiciclici e macrooligociclici, detti criptanti (o criptandi, italianizzando il termine inglese 'cryptands') a causa della loro abilità di circondare sfericamente, 'di seppellire', il catione metallico, sono ancor più stabili dei coronanti. L'aumento della capacità coordinante dei criptanti è legata alla natura tridimensionale della loro cavità ed è definito effetto macrobiciclico.
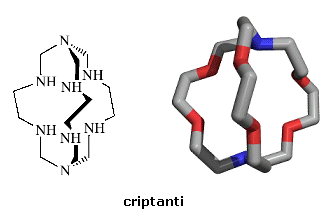
Alcuni criptanti sono detti incapsulanti poichè si formano direttamente intorno allo ione metallico e non possono abbandonarlo. Ne sono un esempio i sepulcrati e le sarcofagine che si formano per reazioni di leganti bidentati che generano complessi tris(chelati) con gruppi a cappa (tripodi) che chiudono sopra e sotto il complesso.
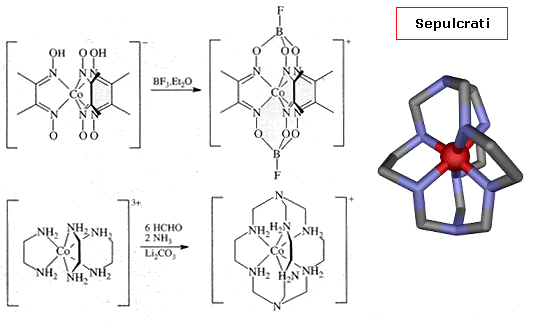
Il primo esempio, riportato da Boston e Rose nel 1968, coinvolgeva la reazione fra tris(dimetigliossimato) di Co(III) con l'acido di lewis BF3.Et2O (boro trifluoruro eterato).
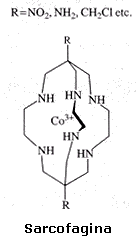
Il termine sarcofagine è usato quando l'atomo cappa è il carbonio.
I leganti dotati di atomi donatori alternativi si dicono ambidentati.
Esempi:
ciano/isociano :CN- e :NC-
tiocianato/isotiocianato :SCN- e :NCS-
nitro/nitrito :NO2- e :ONO-
solfito :SO32- e :OSO22-
L'esistenza del carattere ambidentato genera la possibilità di una isomeria di legame (linkage isomerism), nella quale il medesimo legante si lega tramite atomi diversi.
In caso di incertezza sull'atomo donatore utilizzato è possibile segnalarlo scrivendone il simbolo (in corsivo) preceduto dalla lettera greca kappa ().Il tiocianato che si lega usando l'azoto è tiocianato-N, mentre il tiocianato che si lega usando lo zolfo (isotiocianato) è tiocianato-S. In modo analogo si avrà un nitrito-N ed un nitrito-O, come nel complesso pentaamminonitrito-O-cobalto(III) [Co(NH3)5(NO2-O)]2+. Ad esempio quando l'anione glicinato (gly) si coordina usando l'azoto, l'abbreviazione del legante diventa (gly-N
I leganti che si legano a più di un atomo metallico sono detti leganti polinucleanti o leganti a ponte ed i complessi polimetallici che si formano sono detti complessi polinucleati (dinucleati, trinucleati etc) o complessi a gabbia.
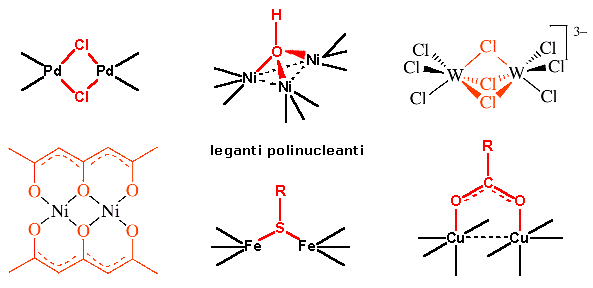
Un esempio di complesso dinucleato è il Tetra--acetato-bis[acquorame(II)]
Vi sono due scritture alternative per la formula:
[Cu2(-CH3CO2)4(H2O)2] in cui si scrivono prima i due atomi del metallo centrale, poi il legante a ponte ed infine gli altri leganti
[(H2O)Cu(-CH3CO2)4Cu(H2O)] in cui gli atomi del metallo centrale vengono scritto separatamente assieme ai rispettivi leganti, intercalati dai leganti a ponte

Un altro esempio è il idrosso-iodio-bis[dicloroplatino(II)]
[Pt2( -OH)( -I)(NH3)4]
o
[(NH3)2Pt( -OH)( -I)Pt(NH3)2]

Il simbolo è usato per indicare l'atomo o il gruppo chimico che fa da ponte tra due atomi metallici. E' possibile far seguire il simbolo da un numero a pedice che indichi il numero di atomi collegati dalla struttura a ponte
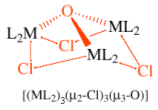
Un tipo particolare di complessi polimetallici sono i complessi a cluster in cui si presentano legami metallo-metallo. Il termine cluster (grappolo) si riserva solitamente ai complessi polimetallici che contengono legami intermetallici diretti e se vi sono almeno 3 metalli legati. Nel nome del complesso il legame metallo-metallo viene indicato tra parentesi come in
[Mn2 (CO)10] bis(pentacarbonilmanganese)(Mn - Mn )
[(CO)5ReCo(CO)4] nonacarbonilreniocobalto(Re - Co)
Alcuni leganti insaturi (con doppi e tripli legami), possono legarsi al metallo centrale utilizzando gli elettroni del doppio legame (legame). Il legante è preceduto dalla lettera greca h (eta), eventualmente seguita da un esponente che indica il numero di atomi del legante che sono 'virtualmente' connessi all'atomo centrale.
|
1° esempio h -etene)tricloroplatinato(II) [PtCl3(h -C2H4)]-
|
2° esempio h -cicloocta-1,5-diene)dimetilplatinato(II) [PtMe2(h -C8H12)]
|
|
3° esempio h -butadiene)tricarbonilferro(0) [Fe(CO)3(h -C4H6)]
|
4° esempio dicarbonil(h -ciclopentadienil)iodioferro(II) [Fe(h -C5H5)I(CO)2]
|

I complessi possono legarsi (specialmente gli ioni complessi) ad altri gruppi chimici. Si definisce in questo caso una sfera interna di coordinazione (inner sphere), costituita dai leganti direttamente uniti all'atomo centrale ed una sfera esterna di coordinazione (outer sphere) che comprende i gruppi (molecole, atomi, ioni) che interagiscono con il complesso senza legarsi direttamente all'atomo centrale.
Se il complesso della sfera interna è uno ione che si lega con ioni di carica opposta o controioni (counterions) della sfera esterna il composto va scritto ponendo, come di consueto nei composti ionici, prima il catione e poi l'anione (B+A-).
1° esempio: [Co(NH3)6]Cl3
Il Co3+ è direttamente legato a 6 NH3. a formare il catione complesso della sfera interna [Co(NH3)6]3+ I 3 ioni Cl- non sono direttamente legati al Co3+ ma interagiscono esternamente con il catione complesso. La nomenclatura di questi sali complessi è del tipo "anione di catione". Per l'esempio corrente si avrà quindi Cloruro di esaammino-Cobalto(III). E' comunque frequente anche una nomenclatura del tipo "catione anione". Per l'esempio corrente si avrà quindi Esaammino-Cobalto(III) Cloruro.
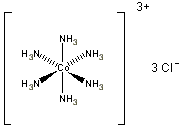
2° esempio K3[Co(CN)5]
Il Co2+ è direttamente legato a 5 CN- a formare l'anione complesso della sfera interna [Co(CN)5]3- I 3 controioni K+ non sono direttamente legati al Co3+ ma interagiscono esternamente con l'anione complesso. In questo caso l'anione complesso va scritto per secondo ed il nome è pentacianocobaltato(II) di Potassio o Potassio pentacianocobaltato(II).
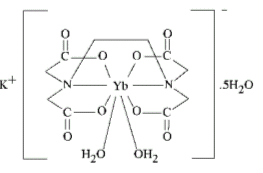
3° esempio K[Yb(EDTA)(H2O)2].5H2O
Si osservi come, in questo caso nella sfera esterna non sia presente solo il controione K+, ma anche cinque molecole di acqua di idratazione, mentre altre due molecole d'acqua sono direttamente legate all'Itterbio(III) nella sfera interna a formare l'anione [Yb(EDTA)(H2O)2]- diacquo(etilendiamminotetracetato)Itterbato(III). L'intero composto prende il nome di:
diacquo(etilendiamminotetracetato)Itterbato(III) pentaidrato di Potassio
o
Potassio diacquo(etilendiamminotetracetato)Itterbato(III) pentaidrato
Il merito di aver chiarito le principali caratteristiche della struttura dei complessi appartiene al chimico svizzero Alfred Werner (1866-1919, premio Nobel nel 1913). Werner capì che in un complesso il metallo centrale poteva legare un numero di gruppi superiore a quelli teoricamente consentiti dalla sua carica. Introdusse pertanto per i complessi il concetto di valenza primaria e valenza secondaria. I due concetti rimangono ancora validi, ma il termine valenza primaria è sostituito dal termine di stato di ossidazione (o numero di ossidazione) del metallo centrale, mentre il termine valenza secondaria è sostituito dal termine numero di coordinazione.
Il numero di coordinazione (N.C.) del complesso è dato dal numero di legami che esso presenta ed è ovviamente pari al numero di leganti monodentati che l'atomo centrale coordina attorno a sé (naturalmente se i leganti sono polidentati il numero di coordinazione non coincide con il numero di leganti).
I complessi metallici mostrano ampia variabilità nel numero di coordinazione, da 1 a 12 e più (per i metalli del blocco f). I numeri di coordinazione più comuni sono 4 e 6
I leganti si distribuiscono intorno all'atomo centrale ordinatamente, andando a formare configurazioni geometriche caratteristiche per ciascun numero di coordinazione, dette geometrie di coordinazione.
Le geometrie ideali di coordinazione per ciascun numero di coordinazione sono riassunte nella tabella successiva. I complessi di coordinazione reali assumono tali geometrie solo in prima approssimazione, poiché spesso sono presenti distorsioni più o meno importanti in relazione al tipo di leganti.
|
N.C. |
Poliedro |
Geometria (simbolo IUPAC) [Simmetria] |
|
|
|
|
|
|
|
Lineare (L-2) [D∞h] |
|
|
|
Planare Trigonale (TP-3) [D3h] |
|
|
|
Piramidale Trigonale (TPY-3) [C3v] |
|
|
|
A forma di T (T-shaped) (TS-3) [C2v] |
|
|
|
Planare Quadrata (SP-4) [D4h] |
|
|
|
Tetraedrica (T-4) [Td] |
|
|
|
Piramidale quadrata (SPY-4) [C4v] |
|
|
|
Ad altalena (See-saw) (SS-4) [C2v] |
|
|
|
Bipiramidale Trigonale (TBPY-5) [D3h] |
|
|
|
Piramidale Quadrata (SPY-5) [C4v] |
|
|
|
Ottaedrica (OC-6) [Oh] |
|
|
|
Prismatica Trigonale (TPR-6) [D3h] |
|
|
|
Bipiramidale Pentagonale (PBPY-7) [D5h] |
|
|
|
Ottaedrica 3-Monocappata (OCF-7) [C3v] |
|
|
|
Prismatica Trigonale 4-Monocappata (TPRS-7) [C2v] |
|
|
|
Dodecaedrica (DD-8) [D2d] |
|
|
|
Antiprismatica Quadrata (SAPR-8) [D4d] |
|
|
|
Cubica (CU-8) [Oh] |
|
|
|
Bipiramidale Esagonale (HBPY-8) [D6h] |
|
|
|
Prismatica Trigonale 3,3-Bicappata (TPRT-8) [C2v] |
|
|
|
Prismatica Trigonale 4,4-Bicappata (TPRS-8) [C2v] |
|
|
|
Prismatica Trigonale 4,4,4-Tricappata (TPRS-9) [D3h] |
|
|
|
Antiprismatica Quadrata 4,4-Bicappata [D4d] |
|
|
|
Ottadecaedrica [C2v] |
|
|
|
Icosaedrica [Ih] |
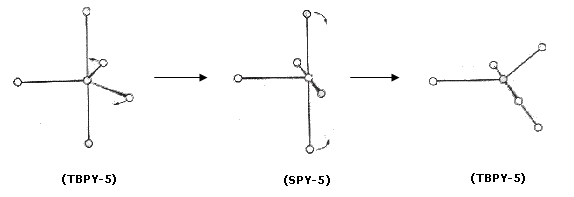
Per alcuni numeri di coordinazione le diverse geometrie sono separate da barriere energetiche molto basse e possono pertanto facilmente convertirsi le une nelle altre (flussionalità). Un esempio è la cosiddetta pseudorotazione di Berry che trasforma la bipiramide trigonale nella piramide quadrata e viceversa
La formula generale di un complesso è del tipo M(AB)xcydz dove M è il metallo centrale, il leganti monodentati vengono indicati con lettere minuscole, mentre i leganti multidentati (chelanti) sono indicati con lettere maiuscole.
Esempi:
Mabcd NC = 4 4 leganti monodentati uno diverso dall'altro
Ma2bc NC = 4 2 leganti monodentati uguali (a) e due diversi (b,c)
M(AA)b2 NC = 4 un chelante bidentato con due atomi donatori uguali (AA) e 2
leganti monodentati uguali (b)
M(AA)2(CD) NC = 6 2 chelanti bidentati uguali (AA) ed uno diverso (CD)
M(ABC)d2e NC = 6 un chelante tridentato (ABC) con tre atomi donatori diversi, 3
leganti monodentati di cui 2 uguali (d) ed uno diverso (e)
M(ABBA)cd NC = 6 un legante tetradentato (ABBA) con atomi donatori a due a due
uguali e due leganti monodentati diversi (c,d)
I composti complessi manifestano numerose forme di isomeria sia nell'ambito dell'isomeria costituzionale che in quello della stereoisomeria
 |
| Appunti su: https:wwwappuntimaniacomscientifichechimicachiralit-nei-complessi84php, |
|
| Appunti Biologia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Geografia |  |