Il calore
Il calore è una forma di energia che si trasferisce tra
due corpi, o tra due parti di uno stesso corpo, che si trovano in condizioni
termiche diverse. Il calore è
energia in transito: fluisce sempre dai punti di temperatura maggiore a quelli di
temperatura minore, finché non viene raggiunto l'equilibrio termico.
La sensazione di
caldo o di freddo che si prova toccando un corpo è determinata dalla sua
temperatura e dalla sua conducibilità termica, ma anche da altri fattori.
Sebbene sia possibile confrontare al tatto, con qualche cautela, le temperature
relative di due corpi, è impossibile darne una valutazione assoluta. Tuttavia,
fornendo calore a un corpo, non solo
si aumenta la temperatura, per cui si avverte una più acuta sensazione di
caldo, ma si producono variazioni direttamente misurabili di alcune proprietà
fisiche. Al variare della temperatura variano infatti le dimensioni del corpo,
la resistenza elettrica e, in alcuni casi, anche la pressione. Queste proprietà
possono essere usate per definire una scala termometrica.Dal
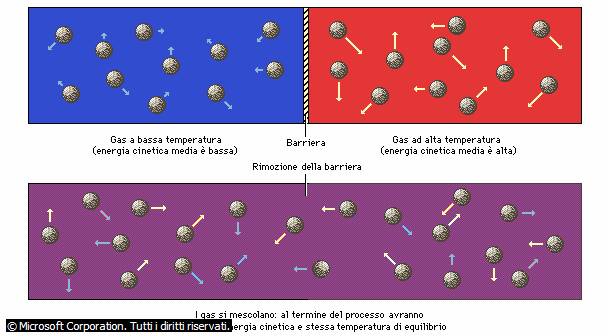
punto di vista microscopico la temperatura di un solido o di un fluido è legata
all'energia cinetica traslazionale media delle molecole che lo costituiscono.
In fisica, si
adotta per il calore la stessa unità
di misura valida per il lavoro e l'energia, cioè il Joule. Spesso tuttavia si
fa uso di un'altra unità, detta caloria, che è definita come la quantità di calore necessaria a portare la temperatura di 1 g di
acqua da 14,5 °C a 15,5 °C in condizioni di pressione ordinarie, e vale 4,185
Joule. La kilocaloria, equivalente a 1000 calorie, è
usata soprattutto in dietologia e in quest'ambito è
spesso detta 'grande caloria'.

L'energia meccanica
può essere trasformata in calore per
effetto dei fenomeni di attrito. Vale il principio di conservazione
dell'energia: tutto il lavoro meccanico compiuto dalle forze di attrito appare
sotto forma di energia termica dei corpi sui quali esso è stato compiuto.
Questo risultato venne dimostrato da Joule con un classico esperimento: egli
fece riscaldare l'acqua contenuta in un recipiente termicamente isolato
facendovi ruotare delle palette e trovò che l'innalzamento della temperatura
dell'acqua era proporzionale al lavoro compiuto per mantenere in rotazione le
palette.
Il principio di
conservazione dell'energia rimane valido se si converte volontariamente il calore in energia meccanica, come ad esempio nelle
macchine termiche o nei motori a combustione interna. Tuttavia, in qualunque
situazione, parte dell'energia viene dissipata sotto forma di calore per effetto dei fenomeni di attrito; in altre
parole nessuna macchina termica può avere un rendimento del 100%.
I cambiamenti di
stato nelle sostanze pure avvengono in condizioni definite di pressione e
temperatura; in particolare, fissate le condizioni di pressione, la temperatura
di transizione è una caratteristica della sostanza in esame. La quantità di calore richiesta per produrre la transizione di fase
per unità di massa di sostanza è detta calore
latente; vi sono quindi calori latenti di fusione, di vaporizzazione e di
sublimazione. Se si porta a ebollizione acqua in un recipiente aperto, alla
pressione di 1 atm, la temperatura non sale oltre i
100 °C, indipendentemente dalla quantità di calore
fornito. Il calore assorbito dall'acqua
è il calore latente, che viene speso
per trasformare l'acqua in vapore ed è pertanto immagazzinato come energia nel
vapore stesso. Analogamente, se si riscalda un miscuglio di ghiaccio e acqua,
la temperatura non varia fino a quando il processo di fusione del ghiaccio non
è completo. Il calore latente
assorbito in questo caso serve a vincere le forze che tengono unite le
particelle di ghiaccio.
Si dice calore specifico di una sostanza la quantità di calore necessaria a innalzare di un grado la temperatura
dell'unità di massa. In relazione alle condizioni di riscaldamento si
distinguono rispettivamente il calore
specifico a volume e a pressione costante. In generale i due calori specifici
dipendono dalla temperatura e, nel caso dell'acqua tutte le sostanze praticamente
incomprimibili hanno valori approssimativamente uguali.

La propagazione del
calore può avvenire per conduzione,
convezione e irraggiamento. Quest'ultimo non richiede il contatto termico tra i
corpi coinvolti nel processo di trasferimento. Il trasferimento di calore da un corpo ad un altro può avvenire tramite
tre meccanismi: conduzione, convezione e irraggiamento.
CONDUZIONE
La conduzione è la
modalità di propagazione del calore
caratteristica dei corpi solidi. Se si riscalda un'estremità di una sbarra, il
calore si trasferisce rapidamente
verso l'altra estremità fino al raggiungimento dell'equilibrio termico, vale a
dire, fino a quando la temperatura della sbarra diventerà uniforme. A livello
microscopico, il trasferimento di calore
da un punto all'altro della sbarra avviene a livello dell'energia vibrazionale
degli atomi o delle molecole che ne costituiscono il reticolo cristallino. Nel
caso specifico dei metalli, che come è noto possiedono numerosi elettroni
liberi, il trasferimento di calore
avviene anche grazie al moto di questi che, urtando tra loro e contro le
molecole del reticolo cristallino, trasferiscono energia da un punto all'altro
del corpo. Ciò spiega perché i buoni conduttori elettrici, che per natura sono
caratterizzati da un'elevata mobilità degli elettroni liberi, sono anche buoni
conduttori di calore. Anche nei
fluidi il calore si può propagare
per conduzione; mentre nei solidi, tuttavia, gli atomi e le molecole occupano
posizioni fisse e l'unico movimento loro possibile è la vibrazione intorno a
tali posizioni, nei liquidi e nei gas le particelle sono libere di traslare e
di urtare l'una contro l'altra. Così, nelle sostanze che si trovano allo stato
fluido, la conduzione del calore
avviene per effetto degli urti tra atomi e molecole: quelli dotati di energia
maggiore, "più caldi", urtano contro quelli dotati di energia minore,
trasferendo loro parte dell'energia.
CONVEZIONE
La propagazione del
calore nei liquidi e nei gas avviene
prevalentemente per convezione, un meccanismo che comporta un effettivo
trasferimento di materia da una parte all'altra del corpo. Quando una sostanza
liquida o gassosa viene riscaldata, la porzione di sostanza più vicina alla
fonte di calore diventa meno densa
e, trovandosi in un campo gravitazionale, tende a salire verso l'alto, mentre
la parte più fredda, più densa e quindi più pesante, tende a scendere verso il
basso. Questo movimento, dovuto alla disuniformità
della temperatura nel fluido, viene detto convezione naturale. Nel caso in cui le
differenze di temperatura all'interno del fluido siano elevate, il moto
convettivo diventa turbolento.
Un esempio di
convezione naturale è quanto avviene quando si riscalda una stanza: l'aria
calda viene spinta a salire verso l'alto, mentre l'aria più fredda viene
attirata dal radiatore. Poiché l'aria calda tende a salire e l'aria fredda a
scendere, si ottiene la massima efficacia di funzionamento da radiatori e
condizionatori d'aria installando i primi vicino al suolo, e i secondi vicino
al soffitto. Il fenomeno della convezione naturale favorisce la risalita
dell'aria calda e del vapore nelle caldaie e l'aspirazione dell'aria nei
camini. La convezione spiega inoltre il movimento delle grandi masse d'aria
intorno alla Terra, l'azione dei venti, la formazione delle nuvole, le correnti
oceaniche e il trasferimento di calore
dall'interno alla superficie del Sole.
IRRAGGIAMENTO
Il trasferimento di
calore per irraggiamento ha
caratteristiche notevolmente diverse rispetto alle altre due modalità: si
tratta infatti di un fenomeno essenzialmente elettromagnetico, che non richiede
il contatto diretto tra i corpi e può avvenire anche nel vuoto. In sostanza,
ogni corpo emette radiazioni elettromagnetiche in misura dipendente dalla sua
temperatura. L'irraggiamento è il modo più efficace per trasmettere il calore.












