 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 7101 | Gradito: |
Leggi anche appunti:Legame ionicoLegame ionico Il legame ionico è il legame che si instaura tra ioni di carica La Storia della ChimicaLa Storia della Chimica Prima di partire con la storia della chimica, è opportuno Paradosso EPR: Entanglement e NonlocalitàParadosso EPR: Entanglement e Nonlocalità Come abbiamo già avuto modo di |
 |
 |
Le semicelle vengono invece convenzionalmente rappresentate mediante una sequenza che inizia con l'elettrodo (in senso stretto), seguito dalle altre specie chimiche coinvolte nella semireazione, specificando tra parentesi lo stato fisico (s = solido, l = liquido, g = aeriforme, aq = soluzione acquosa) e la concentrazione (o la pressione parziale in caso di gas). Se i dati relativi alla concentrazione (o alla pressione parziale) vengono omessi, si assume che l'elettrodo si trovi in condizioni standard (1 M o 1 Atm e 298 K). Si utilizza poi una barra verticale per separare fasi diverse. Specie chimiche presenti in una medesima fase vengono invece separate da una virgola.
Le due semicelle della pila Daniell vengono quindi rappresentate
Cu (s) │Cu2+ (aq) e Zn (s) │ Zn2+ (aq)
Il rame e lo zinco metallici vengono scritti per primi poiché rappresentano gli elettrodi (in senso stretto). Il simbolo│rappresenta una separazione di fase all'interno della semicella tra l'elettrodo in fase solida e lo ione in soluzione acquosa.
Nel caso la coppia redox non presenti specie conduttrici, ad esempio Fe3+/Fe2+, e sia quindi presente un elettrodo inerte, ad esempio Platino, la semicella viene schematizzata iniziando sempre con l'elettrodo inerte, seguito dalla coppia redox, scritta sempre nel senso della riduzione. Le specie che si trovano nella medesima fase vengono separate da una virgola.
Pt (s) │ Fe3+ (aq) , Fe2+ (aq)
Se sono presenti più di due fasi devono essere tutte separate da una barra verticale. È quanto accade ad esempio negli semicelle a gas in cui un elettrodo inerte è a contatto con un gas e con uno ione del gas in fase acquosa. Tuttavia, poiché il gas viene adsorbito sulla superficie dell'elettrodo, potendo in alcuni casi formare con esso un'unica fase, alcuni autori non utilizzano la barra verticale tra elettrodo e gas. Ad esempio per l'elettrodo di ossigeno (coppia redox O2/OH-) si possono avere i seguenti due schemi alternativi per la relativa semicella
Pt(s) │ O2(g) │ OH-(aq) oppure Pt(O2) │ OH-(aq)
Vanno infine riportate nello schema di semicella, oltre alla coppia redox, anche eventuali altre specie chimiche che, pur senza variare il loro numero di ossidazione, partecipino alla reazione e dalla cui concentrazione dipenda il potenziale elettrico della semicella. Non si riportano, invece, né il tipo né la concentrazione degli ioni spettatori (ad esempio gli ioni solfato SO42- della pila Daniell)
Ad esempio la coppia redox MnO4-/Mn2+ è associata alla seguente semireazione di riduzione
MnO4- + 8H+ + 5e D Mn2+ + 4H2O
in cui la variazione nella concentrazione di ioni H+ può modificare l'equilibrio (principio di Le Chatelier) spostandolo verso la specie ossidata (MnO4-) o verso la specie ridotta (Mn2+). Per questo motivo lo ione H+ deve essere riportato nello schema di semicella assieme alla coppia redox MnO4-/Mn2+.
Grafite (s) │ H+(aq) , MnO4- (aq) , Mn2+(aq)
Poiché, come vedremo, il potenziale elettrico di una semicella dipende dalla concentrazione delle specie chimiche coinvolte nella semireazione, una rappresentazione più dettagliata e completa dello schema di una semicella richiede che vengano riportate, racchiuse in parente tonde, oltre allo stato fisico (solido, liquido aeriforme), anche le concentrazioni (nel caso di gas le pressioni parziali) delle diverse specie.
Ad esempio, per concentrazioni unitarie (1 M) e pressione parziale di 1 atm la semicella di ossigeno viene così rappresentata
Pt(s) │ O2(g, 1 atm) │ OH-(aq, 1M) oppure Pt(O2, 1 atm) │ OH-(aq, 1 M)
Diagramma di cella
Un diagramma di cella è una rappresentazione schematica di una pila, in cui compare per prima la semicella anodica, scritta nel senso dell'ossidazione, seguita dalla semicella catodica, scritta nel senso della riduzione, separate dal simbolo che rappresenta il ponte salino (in realtà la notazione IUPAC prevede una doppia linea tratteggiata ¦¦ .
Le parti conduttrici delle semicelle (elettrodi in senso stretto), inerti o meno che siano, sono sempre scritte alle due opposte estremità del diagramma di cella
Ad esempio, il diagramma di cella della pila Daniell è
Zn (s) │Zn2+(aq) Cu2+(aq) │Cu(s)
(-) anodo ponte catodo (+)
Zn(s) │Zn2+(aq) rappresenta la semicella anodica (ossidazione) con la fase solida Zn(s) separata dalla fase acquosa Zn2+(aq)
rappresenta il ponte salino
Cu2+(aq) │ Cu(s) rappresenta la semicella catodica (riduzione) con la fase solida Cu(s) separata dalla fase acquosa Cu2+(aq)
Il medesimo diagramma con concentrazioni degli ioni unitarie (1 M) e ricordando che le concentrazioni dei solidi e dei liquidi puri sono costanti e non compaiono, diventerà
Zn (s) │ Zn2+ (aq, 1 M) Cu2+ (aq, 1 M) │Cu (s)
Come avevamo in precedenza accennato, non sempre in una cella galvanica le semicelle sono fisicamente separate e collegate da un ponte salino (o setto poroso).
Consideriamo ad esempio la cella galvanica che utilizza come anodo un elettrodo ad idrogeno
Pt(s) │ H2(g) │ H+(aq)
e come catodo un elettrodo ad argento-cloruro di argento
Ag(s) │ AgCl(s) │Cl-(aq)
La semireazione di ossidazione all'anodo è
(-) anodo H2(g) D 2H+(aq) + 2e
la semireazione di riduzione al catodo è
(+) catodo AgCl(s) + e D Ag(s) + Cl-(aq)
La reazione complessiva è
2AgCl(s) + H2(g) D 2Ag(s) + 2Cl-(aq) + 2H+(aq)
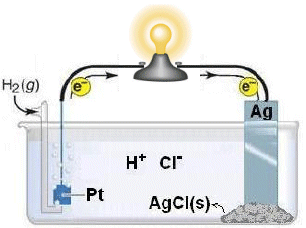
Come si può osservare, i due reagenti (AgCl(s) + H2(g)) si trovano in fasi differenti (uno solido ed l'altro gassoso) e separate e non sono quindi in grado di venire a contatto anche se inseriti in un medesimo contenitore. Non vi è quindi possibilità che avvenga un trasferimento di elettroni all'interno della cella (corto circuito). Inoltre, mentre la pila lavora, l'elettroneutralità viene conservata in quanto la redox libera tanti anioni (Cl-) quanti cationi (H+). La pila non necessita quindi di un ponte salino ed il diagramma di cella sarà
Pt(s) │ H2(g) │ H+(aq) , Cl-(aq) │ AgCl(s) │ Ag(s)
 |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |