 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1704 | Gradito: |
Leggi anche appunti:Numero di ossidazione (nox) o stato di ossidazione (stox)Numero di ossidazione (nox) o stato di ossidazione (stox) Si definisce numero Elettroliti anfoteri in soluzioneElettroliti anfoteri in soluzione Le sostanze che in soluzione possono comportarsi I miscugliI MISCUGLI OBIETTIVO: separare i componenti dei miscugli MATERIALE: polvere |
 |
 |
LE SOSTANZE
1. LE SOSTANZE PURE
I metodi per separare i componenti di una miscela, si basano tutti su trasformazioni fisiche
In una trasformazione fisica la materia può cambiare forma, aspetto o stato fisico, ma non cambia la sua identità chimica (costituzione)
Una sostanza pura è costituita da un campione di materia che non può essere separato in sostanze più semplici attraverso trasformazioni fisiche. Una sostanza pura ha la caratteristica di avere:
una composizione definita e costante
proprietà fisiche e chimiche definite e costanti, indipendentemente dal modo in cui essa è stata ottenuta.
PROPRIETÀ FISICHE
Le proprietà fisiche di una sostanza sono caratteristiche che possono essere osservate senza modificare la sua identità chimica. Sono stato fisico, colore, odore, densità, punto di fusione e punto di ebollizione.
Le trasformazioni fisiche sono quelle in cui le sostanze cambiano le loro proprietà fisiche, mentre la loro composizione chimica rimane costante. Alcuni esempi sono:
ebollizione dell'acqua
fusione del ghiaccio
sublimazione dello iodio
PROPRIETÀ CHIMICHE
Le proprietà chimiche di una sostanza sono fondamentalmente quelle relative alla sua capacità di dar luogo a reazioni chimiche (durante le quali si trasforma in una o più sostanze differenti)
procedimento nel corso del quale una o più sostanze modificano la loro composizione chimica tramutandosi in una o più sostanze differenti.
Alcuni esempi di reazioni chimiche sono:
combustione del carbone o del metano
corrosione del marmo col limone
formazione di ruggine
2. ELEMENTI E COMPOSTI
Scaldiamo una provetta contenente una piccola quantità di ossido di mercurio.
Si osserva che non si ha la fusione del solido, ma lo sviluppo di un gas e la formazione di goccioline dall'aspetto metallico sulle pareti fredde della provetta
L'ossido di mercurio si è decomposto in nuove sostanze: l'ossigeno e il mercurio. Questa reazione chimica si chiama DECOMPOSIZIONE TERMICA e si rappresenta nel seguente modo:
CALORE
OSSIDO DI MERCURIO ======> ossigeno + mercurio
I prodotti della reazione non si possono ulteriormente decomporre e sono quindi corpi semplici o elementi
|
|
Questo apparecchio si chiama
voltametro. Nel recipiente
sono immersi due elettrodi
(bacchette di carbone) che si
collegano con una sorgente di
corrente continua. Il voltame-
tro consente di decomporre
l'acqua nei suoi costituenti,
idrogeno e ossigeno gassosi
attraverso l'azione della cor-
rente elettrica: questo proce-
dimento si chiama
ELETTROLISI
energia elettrica
ACQUA============> idrogeno + ossigeno
Da queste due esperienze possiamo concludere che le sostanze pubbliche si possono dividere in due gruppi:
Composti = sostanze pure che, sottoposte a particolari trattamenti chimici, si possono decomporre in due o più sostanze più semplici.
Elemento = sostanze pure che non possono essere decomposte in sostanze più semplici, qualunque sia il trattamento chimico a cui vengano sottoposte.
3. LA DIFFUSIONE DEGLI ELEMENTI CHIMICI
Gli elementi chimici non sono ugualmente distribuiti in natura
|
ELEMENTO |
UNIVERSO % |
SISTEMA SOLARE % |
|
idrogeno |
|
|
|
elio |
|
|
|
tutti gli altri elementi |
|
|
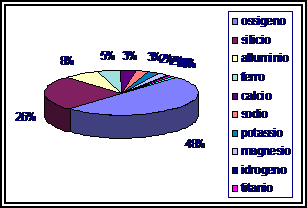

CROSTA TERRESTRE CORPO UMANO
4. I NOMI E I SIMBOLI DEGLI ELEMENTI CHIMICI
Per il momento sono noti 109 elementi chimici.
Nove di essi (rame, oro, argento, mercurio, piombo, ferro stagno, zolfo e carbonio) erano conosciuti fin dai tempi più antichi perché si trovavano allo stato libero o nativo in natura o perché si potevano estrarre facilmente dai loro minerali.
Una serie di altri elementi non presenti in natura, è stata ottenuta nel corso di reazioni di fissioni nucleare o di esperimenti condotti in acceleratori di particelle che permettono di trasformare un elemento chimico in un altro di natura differente => elementi artificiali
I nomi degli elementi chimici hanno varia origine:
derivano dai nomi latini o greci (bromo e cloro) che ne descrivono una proprietà dell'elemento
derivano da un nome geografico (americio, polonio, californio)
dai nomi degli scienziati che li hanno scoperti (einstenio, fermio)
Fin dai tempi degli alchimisti si rappresentavano gli elementi tramite dei simboli. Grazie al grande chimico svedese J.J. Berzelius è stato introdotto l'attuale sistema di simboli basati sull'uso delle lettere dell'alfabeto. I simboli possono essere formati da
una sola lettera (l'iniziale del nome)
due lettere che possono essere le prime due del nome
due lettere che possono essere la prima e un'altra lettera del nome
lettere che si rifanno al nome latino
5. METALLI, NON METALLI, SEMIMETALLI
Gli elementi chimici possono essere classificati in:
metalli, che vengono largamente utilizzati, e che ci sono particolarmente familiari
non metalli, che hanno notevoli applicazioni in molti settori che interessano la nostra vita quotidiana
semimetalli, che sono adatti ad applicazioni nel campo della microelettronica.
presentano proprietà intermedie tra quelle dei metalli e quelle dei non metalli.
tra essi configura il boro, il silicio, l'arsenico, il germanio, il tellurio
sono tutti solidi
presentano caratteristiche da semiconduttori
|
PROPRIETA' FISICHE |
METALLI (rame, ferro, oro) |
NON METALLI (azoto, cloro) |
|
stato fisico a temperatura ambiente |
solitamente solidi (tranne il mercurio che è liquido) |
solidi (carbonio, fosforo, zolfo, selenio, iodio), liquidi (bromo), gassosi (tutti gli altri) |
|
punto di fusione e di ebollizione |
solitamente alto |
relativamente basso |
|
densità |
solitamente alta |
relativamente bassa |
|
aspetto |
lucidi e splendenti |
opachi |
|
malleabilità |
solitamente possono essere tirati in fili (sono duttili) e malleabili |
sono molto fragili (non malleabili) |
|
conducibilità termica ed elettrica |
elevata |
bassa (tranne il carbonio sotto forma di grafite) |
|
PROPRIETÀ' CHIMICHE |
METALLI (rame, ferro, oro) |
NON METALLI (azoto, cloro) |
|
|
scarsa tendenza a combinarsi l'uno con l'altro forte tendenza a combinarsi con i non metalli in natura si trovano combinati con altri elementi sotto forma di minerali soltanto oro, rame e argento si possono trovare in natura allo stato libero o nativo |
si possono combinare l'uno con l'altro per formare composti quelli che si trovano liberi in natura sono carbonio, azoto, ossigeno, zolfo e i gas nobili (elio, neon, argo, kripto, xeno e rado) |
LA TAVOLA PERIODICA
I metalli, i non metalli e i semimetalli sono raggruppati in determinate zone della tavola periodica.
Metalli = parte sinistra e centrale
Non metalli = parte destra
I semimetalli = tra le due fasce precedenti
6. LE PARTICELLE MINIME CHE COSTITUISCONO GLI ELEMENTI E I COMPOSTI
Un atomo è la più piccola particella esistente di un elemento che ne conserva tutte le caratteristiche
gli elementi sono costituiti da atomi
non sono indivisibili, ma sono costituiti da particelle ancora più piccole, le particelle subatomiche
non conservano le proprietà degli elementi
Una particella formata dall'unione di più atomi forma una molecola. Le molecole possono essere formate da:
due o più atomi identici = rappresentano le particelle di un elemento
atomi di elementi differenti = rappresentano le particelle più piccole di un composto
Le forze che tengono uniti gli atomi di una molecola sono dette legami chimici
7. LE FORMULE CHIMICHE
I composti vengono rappresentati in modo abbreviato attraverso le loro formule. Una formula chimica evidenzia:
gli elementi che formano un composto
il rapporto numerico in cui i loro atomi sono combinati nella molecola
CARATTERISTICHE (pag. 60)
Nella formula di un composto si rappresentano i simboli di TUTTI gli elementi in esso presenti
Il simbolo di un elemento indica che la formula contiene solo un atomo di quell'elemento
Se sono presenti più atomi di un certo elemento il numero atomico viene indicato con un numero (indice) scritto in basso a destra di quell'elemento
Se nella formula è presente più di una volta un gruppo di atomi, questo viene racchiuso tra parentesi e a destra si scrive l'indice
8. CONFRONTO FRA LE CARATTERISTICHE DI UNA MISCELA E QUELLE DI UN COMPOSTO
Una miscela è un sistema che contiene sempre due o più sostanze che possono essere presenti in quantità variabile.
|
CARATTERISTICA |
COMPOSTO |
MISCELA |
|
Proprietà dei componenti |
ha proprietà completamente differenti dagli elementi da cui è formato |
i componenti non perdono la loro identità |
|
Separazione dei componenti |
gli elementi costituenti possono essere separati soltanto con mezzi chimici |
la separazione dei componenti può avvenire con mezzi fisici e meccanici |
|
Composizione |
i due o più elementi costituenti sono combinati in un rapporto in peso definito e costante |
può essere formata da elementi o da composti oppure da entrambi secondo un rapporto di peso variabile |
 |
| Appunti su: |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |