 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2130 | Gradito: |
Leggi anche appunti:Elettroliti, non-elettroliti e grado di dissociazioneElettroliti, non-elettroliti e grado di dissociazione Le sostanze che si La struttura della materia: atomi ed elementiLa struttura della materia: atomi ed elementi Le prime ipotesi sulla struttura Misure della massa e della densità d'acqua e alcoolMisure della massa e della densità d'acqua e alcool Obiettivi: misurazione |
 |
 |
L'ACQUA IN GENERALE E COME COMPOSTO CHIMICO
L'acqua è nient'altro che un composto chimico di formula H2O , che si presenta come un liquido incolore e insapore.
Essa è diffusa in natura nei suoi tre stati d'aggregazione: solido, liquido e aeriforme . Nel linguaggio corrente s'intende in genere l'acqua allo stato liquido, che per la sua abbondanza sulla superficie terrestre e negli organismi viventi fu dagli antichi considerata come uno dei quattro elementi.
Per molto tempo l'acqua fu considerata come un elemento; H. Cavendish e A.L. Lavoisier ne stabilirono per primi la composizione ed il metodo di sintesi.
L'acqua si forma per azione dell' idrogeno sui composti ossigenati (ossido di rame , ecc.) , per combustione dell' idrogeno e di composti contenenti idrogeno; ma normalmente non si prepara mai acqua per mezzo delle sue numerose reazioni di sintesi data la diffusione con cui essa si presenta in natura in tutti e tre gli stati di aggregazione.
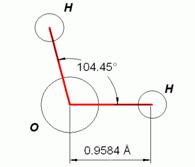 La molecola dell'acqua, H 0 ha una struttura a forma di V con una disposizione degli atomi
del tipo raffigurato nella figura accanto.
La molecola dell'acqua, H 0 ha una struttura a forma di V con una disposizione degli atomi
del tipo raffigurato nella figura accanto.
Con diversi sistemi si è potuto misurare l'angolo formato dai due legami O-H che è di 104.45° e la lunghezza del legame stesso che è di 0.9584 A.
L'acqua però normalmente non si presenta con questa formula semplice. Infatti si ammette che queste molecole semplici esistano solo nel vapore : in contrasto con l'esistenza, nell'acqua liquida ,di molecole semplici H 0 , sono la maggior parte delle costanti fisiche e chimico-fisiche dell'acqua. Cosi contrastano con questa formula i punti di congelamento e di ebollizione, e male si accordano le variazioni della densità, del calore specifico, ecc.
Tali anomalie si possono spiegare ammettendo l'esistenza nell'acqua liquida e nel ghiaccio di molecole associate . Nel ghiaccio le molecole sono disposte in modo tale che ciascun atomo di ossigeno risulta circondato da altri quattro ( di altre quattro molecole) disposti in una struttura tetraedrica . Questa struttura ordinata viene alterata da diversi fattori (innalzamenti di temperatura, aggiunta di sali, ecc.). L'elevato valore della costante dielettrica dell'acqua ne fa uno dei liquidi di più alto potere dissociante o ionizzante; gli acidi, le basi e molti sali in essa disciolti si dissociano, più o meno in ioni (che vi si conservano in virtù appunto dell'alto valore della costante dielettrica e che sono della massima importanza per l'effettuarsi delle reazioni in soluzione, per i fenomeni e i processi di elettrolisi). La stessa acqua è dissociata, debolmente , nei suoi ioni, e questo permette la spiegazione dei fenomeni di idrolisi che in essa avvengono. In fase vapore la molecola H 0 subisce un altra dissociazione, termica , che diviene sensibile a temperatura dell'ordine dei 2000°C e cresce al di sopra di questa.
L'acqua ha proprietà solventi verso la maggior parte dei composti; gli acidi , gli ossidi, i sali anidridi si sciolgono con sviluppo di calore (causa l'idratarsi dei loro ioni) mentre i sali idrati in genere si sciolgono producendo un raffreddamento della soluzione. Dalle soluzioni acquose molti sali cristallizzano anidri mentre altri cristallizzano trattenendo acqua in un dato rapporto, formando cioè dei sali idrati definiti.
L'acqua si combina con molti metalli (con quelli alcalini a freddo, con gli altri a caldo), con gli ossidi ( formando gli idrati), con le anidridi formando gli acidi; presenta le proprietà di catalizzare molte reazioni che in sua assenza avverrebbero con difficoltà .
Esistono numerosi tipi di acqua che dipendono dal ruolo che esse svolgono.
Si definisce acqua di costituzione quella chimicamente combinata a formare un composto chimico (per esempio l'acqua che si combina con un ossido metallico o con un anidride per formare rispettivamente un idrato o un acido), e che viene eliminata dai composti solo a temperature piuttosto elevate .
Si definisce acqua di cristallizzazione quella presente in un composto chimico, di solito detto idrato,; essa viene addizionata al composto, inorganico o organico, e tenuta fissata da valenze secondarie; è presente in proporzioni diverse ma definite; si elimina di solito al di sotto di 100°C, e questa eliminazione porta per lo più ad una alterazione della forma cristallina del composto.
L'acqua di impregnamento o di assorbimento è quella contenuta in determinati minerali, a seguito di un lento impregnamento, all'atto dell'estrazione dal giacimento ( per esempio in alcune bauxiti più del 10%).
Acqua di interposizione è quella che rimane racchiusa o interposta fra i cristalli di un composto durante la sua cristallizzazione: non ha quindi rapporti di composizione chimica col composto e quando questo viene riscaldato l'eliminazione dell'acqua da origine a crepitazioni.
La composizione chimica delle acqua naturali dipende dalla natura dei terreni da cui sorgono o vengono raccolte e fra i numerosissimi elementi chimici che possono essere presenti oltre all'idrogeno e all'ossigeno sono: cloro, bromo, carbonio, fosforo, azoto, boro, arsenico, sodio, potassio, litio, calcio, stronzio, bario, magnesio, ferro, alluminio, manganese, silicio, zolfo, argento e iodio.
Le più importanti caratteristiche fisiche e chimiche delle acque naturali, dalle quali dipende poi il loro impiego sono: acidità, durezza, odore, residuo fisso o salinità, sapore, temperatura e torbidità.
L'acidità è dovuta alla presenza di acidi disciolti.
Le acque si distinguono in acide (pH<7), in neutre (pH=7) e in alcaline (pH>7); le acque acide sono anche dette aggressive in quanto intaccano i metalli con i quali vengono a contatto.
La durezza è una caratteristica data dalla presenza di sali di calcio e di magnesio, la durezza delle acque si misura in gradi francesi [F], che esprimono in grammi di carbonato di calcio la percentuale dei sali di calcio o di magnesio contenuti in 100 litri di acqua e corrisponde al contenuto di 1gr. di
di CaCo per ettolitro o all'equivalente molecolare in grammi degli altri sali.
In base alla durezza le acque si distinguono in dolci o molli (da 0° a 14° [F]), dure (da 14° a 54°[F]) e durissime (più di 54°[F]).
L'odore deriva dai gas disciolti, soprattutto dalla presenza di idrogeno solforato che può dipendere da gas endogeno o da sostanze in putrefazione.
Il residuo fisso o salinità è il peso delle sostanze contenute in un litro d'acqua filtrata, si ottiene evaporando l'acqua e seccando il residuo per quattro ore a 110°C
Il sapore secondo le sostanze disciolte può essere dolce, amaro, salato e acido.
La temperature dipende dalle condizioni termiche del suolo e dell'aria con cui le acque sono state a contatto; alcune acque di profondità presentano una temperatura molto più elevata di quelle sulla superficie e prendono il nome di acque termali.
L'acqua potabile dovrebbe avere una temperatura non inferiore a 6°C e che non superi i 14°C
La torbidità è prodotta di solito da sostanze argillose colloidali o da idrossidi di ferro in sospensione.
Qui di seguito verranno elencate le caratteristiche chimico fisiche dell'acqua pura.
punto di fusione0,00°C pressione critica.217,7atm
punto di ebollizione100,00°C costante dielettrica a 18°C.81,07 Farad/m
peso specifico a 0°C0,999868 grp/cm conducibilità termica
" " a 4°C..1,00000 " (fra 10°e18°C).0,00154 cal/cm.sec.°C
" " a 20°C0,998230 " conducibilità elettrica a 18°C..3,8*10^-8 ohm cm
" " del ghiaccio 0°C0,9168 " temperatura critica..374°C
 densità del vapor d'acqua
a O°C
densità del vapor d'acqua
a O°C
(riferita ad aria=1)0,624
calore specifico dell'a. a 15°C.1,0000 cal/grm
calore specifico del ghiaccio a 0°C..0,487 "
calore specifico del vapore a 100°C.0,462 "
calore di fusione del ghiaccio a 0°C.79,40 "
calore di evaporazione dell'a, a 100°C539,1 "
momento dipolare..1,84*10^-18
viscosità a 0°C0,01792 poise
a 20°C..0,01005 "
a 100°C.0,00284 "
coefficiente di compressibilità.0,000045 cm /kgp
tensione superifciale a 0°C.75,6 dine/cm
 |
| Appunti su: os elementos magnesio e bromo combinam -se diretamente para formar o composto, |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Ingegneria tecnico |  |