 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1823 | Gradito: |
Leggi anche appunti:Distillazione e diagramma lenticolareDistillazione e diagramma lenticolare Per descrivere il processo di distillazione Idrolisi acidaIdrolisi acida a) sale derivato da acido forte e base debole Si produce Dipendenza delle funzioni di stato dalla Temperatura: Calore SpecificoDipendenza delle funzioni di stato dalla Temperatura: Calore Specifico Il |
 |
 |
Gli Orbitali ibridi
L'Ibridizzazione prende origine dal fatto che un legame covalente o un lone pair sono zone dello spazio elettricamente cariche.
Inoltre l'ibridizzazione è un ulteriore strumento per determinare la forma geometrica delle molecole.
Ciascuna di tale zona tende a orientarsi rispetto alle altre in modo che le distanze siano massime in modo da avere la minima repulsione e il contenuto di energia sia minimo nel loro insieme.
L'ibridizzazione è una trattazione matematica mediante la quale orbitali di tipo diverso (s , p , d) di uno stesso atomo e con contenuti di energia poco diversi, vengono dapprima mescolati tra loro e poi ridivisi in numero di orbitali uguale a quello degli orbitali puri di partenza, imponendo la condizione che questi nuovi orbitali (ORBITALI IBRIDI) siano isoenergetici.[2]
Rispetto agli orbitali atomici cui derivano una concentrazione delle nubi elettroniche in definite direzioni dello spazio e in essi uno dei due lobi che rappresentano la disposizione spaziale di carica è maggiore dell'altro; questi addensamenti di carica consentono maggiori ricoperture, e gli orbitali ibridi formano quindi legami più forti che non gli orbitali semplici da cui derivano.
Per chiarire il concetto di orbitale ibrido prendiamo in esempio il metano (CH4):
la configurazione elettronica esterna dell'atomo di carbonio ( C ) nel suo stato fondamentale è 2s2 2p2
dalla sua configurazione esterna si potrebbe quasi dire che l'atomo di C potrebbe fare solo 2 legami covalenti tanti quanti sono i suoi elettroni spaiati nell'orbitale p; invece l'atomo di c forma 4 legami covalenti assolutamente equivalenti tra loro (isoenergetici).
Il fatto che l'atomo di c formi 4 legami covalenti deriva dal fatto che esso scinde il lone pair 2s promovendo un elettrone 2s2 a un elettrone 2p, passando dallo stato fondamentale allo stato eccitato.
Ciò spiega come il carbonio riesca a formare 4 legami covalenti e come i legami C-H siano assolutamente isoenergetici
Che tre di questi legami siano isoenergetici si potrebbe giustificare considerando che provengono dai 3 orbitali 2p, ma il quarto legame dovrebbe essere di energia diversa provenendo dall'orbitale 2s. Ciò viene superando ammettendo l'ibridizzazione dell'orbitale 2s e dei tre 2p in 4 orbitali ibridi sp3.
IBRIDIZZAZIONE sp
Deriva dal mescolamento di un orbitale s e di uno p dello stesso atomo, con lo stesso numero quantico n, questi formano fra loro un angolo di 180°, cioè sono allineati in posizione simmetrica rispetto al nucleo, tale disposizione garantisce la minima repulsione. (struttura lineare)
IBRIDAZZIONE sp2
Deriva dal mescolamento di un orbitale s e di due orbitali p dello stesso atomo, con lo stesso numero quantico n.
I tre orbitali ibridi cosi formati risulteranno a 120° fra loro e quindi considerando il nucleo dell'atomo al centro di un triangolo equilatero, gli orbitali sp2 sono diretti verso i vertici di tale triangolo. (struttura trigonale planare)
IBRIDIZZAZIONE sp3
Deriva dal mescolamento di un orbitale s e di 3 p con lo stesso valore n.
I quattro orbitali ibridi sp3 formano tra loro un angolo di 109,5° e sono diretti verso i vertici di un tetraedro il cui nucleo dell'atomo occupa il centro.
(struttura tetraedrica regolare)
Esempi di ibridizzazione sp, sp2, sp3:
- BeCl
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
-BCl3
![]()

![]()
CCl4
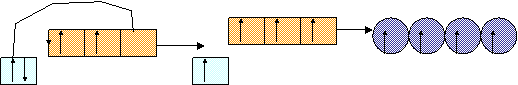
![]() Legenda:
Legenda:
![]()
![]()
orbitale s orbitale p orbitale ibrido
IBRIDIZZAZIONE sp3d
Deriva dal mescolamento e successiva equiripartizione dell'energia contenuta in un orbitale s, tre orbitali p e uno d, chiaramente di uno stesso valore quantico principale.
L'ibridizzazione a sp3d avviene
solo per quegli atomi che hanno un numero quantico da
La struttura geometrica che forma è quella di una bipiramide trigonale con tre angoli di 120°, sul piano
del triangolo e gli altri di 90°.
Un esempio di tale ibridizzazione è il PCl5
IBRIDIZZAZIONE sp3d2
Anche questo orbitale ibrido deriva da un mescolamento di un orbitale s, tre p e di de orbitale d, tutti col medesimo numero quantico principale.
Anche
qui questo orbitale ibrido avviene per quegli atomi con numero quantico dal
La struttura che si ottiene da tale ibridizzazione è quella ottaedrica.
L'ibridizzazione degli orbitali rende conto anche di alcune anomalia riguardante la loro geometria molecolare presenti in alcune molecole, tra questi principalmente le molecole dell'acqua (H2O) e dell'ammoniaca (NH3)
1.si è visto che i legami H-O della molecola dell'acqua formano un angolo di 104à circa anziché 90° (come dovrebbe essere se si utilizzassero orbitali p puri).
Anche per l'ossigeno bisogna supporre che avvenga un ibridizzazione dell'orbitale s con i tre orbitale p con la formazione di 4 orbitali sp3, due dei quali ospitano un lone pair, mentre gli altri due ospitano un elettrone spaiato ciascuno, che accoppiandosi con i due elettroni dei 2 idrogeni dovrebbero formare come tutti gli orbitali sp3 un angolo di legame di 109°, come previsto da una disposizione tetraedrica.
L'angolo di circa 104°, corrisponde a una disposizione tetraedrica distorta giustificata dal fatto che i 2 orbitali ibridi contenenti i lone pair, esercitano una repulsione maggiore sugli elettroni impegnati nei legami H-O
![]()
![]()
![]()
![]()
![]()
Anche per quanto riguarda l'azoto dell'ammoniaca, bisogna supporre che si utilizzi orbitali ibridi sp3 a struttura tetraedrica, con angoli di 107° tra i legami N-H, per effetto della compressione questa volta inferiore esercitata dal solo doppietto non condiviso dell'azoto.
![]()

![]()
![]()
Lone pair
Struttura della molecola di H2O e NH3
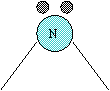


![]()
![]() ~104°
~104°
![]()
![]() 107°
107°

![]()
 |
| Appunti su: |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |