 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1748 | Gradito: |
Leggi anche appunti:Strategia di bilanciamento di reazioni redox in forma ionica nettaStrategia di bilanciamento di reazioni redox in forma ionica netta Spesso Elettroliti anfoteri in soluzioneElettroliti anfoteri in soluzione Le sostanze che in soluzione possono comportarsi Simbologia chimicaSimbologia chimica Ogni elemento chimico viene convenzionalmente indicato |
 |
 |
Per compredere l'effetto della pressione sull'equilibrio chimico puoi fare riferimento al principio di Le Chatelier, secondo il quale un sistema reagisce ad una variazione imposta dall'esterno in modo da minimizzarne l'effetto.
Ovviamente
un effetto della pressione sarà apprezzabile, in pratica, solo per reazioni in
fase gassosa.
Inoltre, l'effetto si fa sentire solo nel caso di reazioni che comportino,
nella loro stechiometria, variazione del numero di moli.
Cosa significa variazione del numero di moli?
Significa che in seguito allo spostamento dell'equilibrio di reazione il numero di molecole totali presenti subisce una variazione.
Un esempio classico di una reazione in cui si ha variazione del numero di moli
è la reazione di sintesi dell'ammoniaca a partire dagli elementi idrogeno e
azoto.
Infatti la stechiometria della reazione:
3H2 + N2 = 2 NH3
indica che per ogni 3+1=4 moli di reagenti che reagiscono si formano 2 moli di prodotto.
Al contrario, nella reazione (altrettanto classica):
H2 + I2 = 2 HI
non vi è variazione del numero di moli : 2 a sinistra, 2 a destra.
Inizio modulo
Fine modulo
Una variazione di pressione imposta al sistema ha dunque effetto solo sulle reazioni del primo tipo. L'aumento di pressione si può ottenere o riducendo il volume del sistema, oppure introducendo nel sistema un gas inerte.
Qual è questo effetto?
Se, ad esempio, si aumenta la pressione, come può fare il sistema a minimizzare la variazione imposta? ovvero come si può ridurre la pressione?
Risposta: Riducendo il numero di moli totali presenti nel sistema.
(L'equazione di stato dei gas ideali indica che P ed n sono direttamente
proporzionali)
Come si può
ridurre il numero di moli totali nella reazione di sintesi dell'ammoniaca?
Risposta: Spostando l'equilibrio della reazione a destra. (La sintesi di
ammoniaca fa sì che vengano consumate più moli, o, se vuoi, molecole, di quelle
che si formano).
In sintesi
In una reazione in cui si ha variazione del no. di moli, un aumento di pressione sposta l'equilibrio dalla parte dove vi è un numero di moli minore; viceversa, una diminuzione della pressione sposta l'equilibrio dalla parte dove vi è un no. di moli maggiore.
Questa spiegazione non mi basta, vorrei approfondire l'argomento
Ti
accontento, ma bada bene che talvolta gli approfondimenti possono complicare la
vita.
La richiesta è comunque legittima; dietro ad ogni legge, regola o principio vi
è un motivo. E questo motivo può avere molteplici facce, può essere
giustificato in termini termodinamici, oppure elettronici, attraverso modelli
teorici, o infine dal punto di vista puramente matematico.
Percorriamo, per maggior semplicità, quest'ultima via.
Riprendiamo la nostra reazione:
3H2 + N2 = 2 NH3
La Keq di questa reazione si può esprimere sia in termini di concentrazioni, sia di pressioni parziali. Nel primo caso, non puoi aspettarti di avere informazioni circa un eventuale effetto della pressione.
Esprimiamo quindi la Keq della reazione in funzione delle pressioni parziali:
![]()
Per semplicità, immaginiamo di partire con 3 moli di H2 e 1 mole di N2. La reazione parte, e una volta raggiunto l'equilibrio la pressione sia = P atm.
La stechiometria della reazione ti dice che per ogni 3 moli di H2 che
reagiscono con 1 mole di H2, si formano 2 moli di NH3.
O anche, che per ogni mole di ammoniaca che si forma, ha reagito 1/2
mole di azoto e 3/2 di mole di idrogeno.
Se indichiamo con x il no. di moli di ammoniaca all'equilibrio, le moli di H2 e N2, sempre all'equilibrio, saranno rispettivamente (3-3/2 x) e (1-1/2 x).
A questo punto possiamo utilizzare la legge di Dalton delle pressioni parziali per esprimere la nostra Kp.
Ti ricorderai che le pressioni parziali si possono esprimere attraverso le
frazioni molari. Ovvero, se Xa è la frazione molare di A, la pressione parziale
di A, Pa, è Pa = Xa P, dove con P si indica la pressione totale. La frazione
molare di A è il rapporto fra no. di moli di A e no. di moli totali.
Le moli totali del nostro sistema si ottengono dalla somma delle moli di H2, N2 e NH3, ovvero:
(3-3/2 x) + (1-1/2 x) + x = 4 - x
Di conseguenza, le pressioni parziali sono:
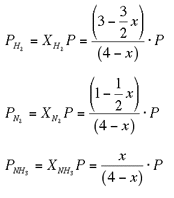
Sostituendo nella 1.1, otteniamo:
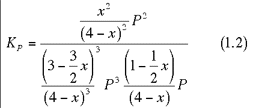
che, semplificando, si riduce a:
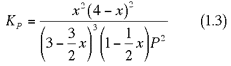
E la chiave di lettura è tutta in questa equazione.
Poiché Kp è costante (ovviamente per T costante), se P aumenta, affinché Kp resti costante, deve aumentare la quantità al numeratore, ovvero la quantità di ammoniaca. Per cui, H2 e N2 reagiscono ulteriormente, diminuisce la loro concentrazione, ed aumenta quella dell'ammoniaca.
Verifica di apprendimento, nonché di validità del trattamento
Il valore di Kp per la reazione di sintesi dell'ammoniaca a 350°C è 0.0009 atm-2. Calcolare la pressione parziale dell'ammoniaca alla pressione di 1 atm e di 100 atm. Se la massa dell'ammoniaca è 3.4 grammi, qual è il volume della miscela di reazione alle due pressioni? Suggerimento: Se non siete in grado di risolvere l'equazione di 4° grado, attraverso una semplificazione si può arrivare a formulare la 1.3 in termini di una equazione di 2° grado; in tal caso la Kp vale 0.03 atm-1.
Soluzione
La soluzione della prima parte è puramente matematica. Si può arrivare a formulare un'equazione di 2° grado in due modi.
1. Dividendo la stechiometria della reazione di formazione dell'ammoniaca per 2; ovvero:
3/2H2 + 1/2N2 = NH3
Per cui Kp diventa:
![]()
E ciò consente di abbassare di 2 'gradi' l'equazione finale.
2. Facendo la radice quadrata dell'equazione 1.3. Che è esattamente la stessa cosa del punto precedente. Ecco due o tre 'passaggi':
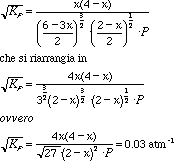
Risolvendo per P = 1 atm, si ottiene x = 0.04 moli di NH3; per P = 100 atm, x = 1.1 moli di NH3
La seconda
parte del problema richiede solo poche nozioni elementari di chimica.
Affinché si formino 3.4 g di ammoniaca (3.4/17=0.2 moli), a 1 atm, è necessario
che le quantità dei reagenti siano 0.2/0.04 = 5 volte maggiori di quelle
stechiometriche. Ovvero, occorrono 15 moli di H2 e 5 moli di N2, che
all'equilibrio diventano rispettivamente (15-3/2*0.2)=14.7 e (5-1/2*0.2)=4.9.
Le moli totali all'equilibrio sono quindi 14.7+4.9+0.2= 19.8. Allo stesso
valore di moli totali si arriva da no. moli totali = (4-x) = (4*5-x)= 19.8.
Infine da V=nRT/P, ricordando che t=350°C, si ottiene ca. 1012 litri.
Per ottenere la stessa quantità di ammoniaca a 100 atm, è sufficiente partire con quantità dei reagenti 0.2/1.1= 0.182 volte quelle stechiometriche (0.545 e 0.182 moli, rispettivamente per H2 e N2, che all'equilibrio diventano 0.245 e 0.082). Le moli totali sono quindi 0.245+0.082+0.200= 0.528. Lo stesso valore si ottiene da no. moli totali = (4-x) = (4*0.182-x)= 0.528. Da V=nRT/P, si ottiene infine ca. 0.27 litri.
 |
| Appunti su: |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |